Соединения галогенов
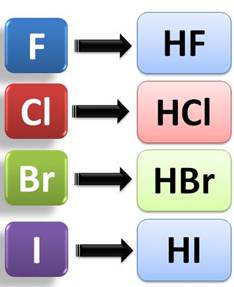
Среди соединений галогенов следует выделить галогеноводороды. Само название говорит о том, что в состав этих соединений входят атомы водорода и галогена.

Галогеноводороды представляют собой бесцветные газы, с резким запахом, они токсичны, очень хорошо растворяются в воде с образование соответствующих кислот.
Если растворить хлороводород в воде с лакмусом, то лакмус изменит свою окраску с фиолетовой на красную.

Галогеноводороды дымятся во влажном воздухе, потому что притягивают к себе водяные пары, находящиеся в воздухе, образуя, при это, туманное облако.
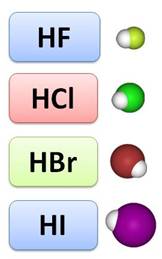
Растворы галогеноводородов в воде являются кислотами. Так, HF – фтороводородная, или плавиковая кислота, HCl – хлороводородная, или соляная кислота, HBr – бромоводородная кислота, а HI – йодоводородная кислота.
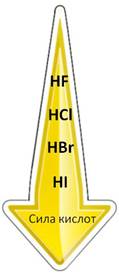
В ряду от плавиковой до йодоводородной кислоты сила кислот увеличивается, так как увеличивается их способность к электролитической диссоциации с образованием ионов водорода. Самая слабая из этих кислот плавиковая, а самая сильная – йодоводородная. В HF расстояние между ядрами атомов маленькое, радиус атома фтора тоже, поэтому прочность связи высокая, поэтому и способность к диссоциации небольшая, а у HI радиусы атомов большие, расстояние между ядрами атомов тоже, поэтому эта кислота легко диссоциирует на ионы.
Наибольшее значение имеет хлороводород и соляная кислота. В промышленности хлороводород получают синтезом водорода и хлора.
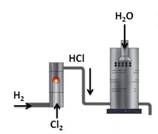

А в лаборатории хлороводород получают действием концентрированной серной кислоты на кристаллический хлорид натрия.


Соляная кислота – это бесцветная жидкость, дымящаяся на воздухе. Тяжелее воды. В химических реакциях она проявляет свойства типичных кислот.
Соляная кислота реагирует с металлами, стоящими в ряду напряжений металлов до водорода. В реакции соляной кислоты с цинком образуется соль – хлорид цинка и газ – водород.
Это окислительно-восстановительная реакция, в которой атом цинка повышает свою степень окисления с 0 до +2, поэтому цинк – восстановитель, водород понижает свою степень окисления с +1 до 0, поэтому водород – окислитель.

Соляная кислота взаимодействует с основными оксидами. Так, в реакции оксида магния с соляной кислотой образуется соль – хлорид магния и вода.
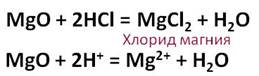
Соляная кислота реагирует с основаниями. В этих реакциях образуется соль и вода.
В результате взаимодействия гидроксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.
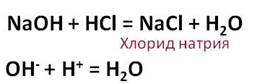
Соляная кислота реагирует с солями слабых кислот. Так в реакции соляной кислоты с карбонатом кальция образуется новая соль – хлорид кальция и слабая кислота – угольная, которая распадается на углекислый газ и воду.
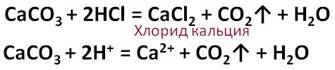
Соляная кислота имеет большое значение. Её применяют для очистки поверхности металлов, при паянии, получении солей, в производстве пластмасс и других синтетических материалов, в получении лекарственных препаратов и красок.

Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды и йодиды. Хлориды, бромиды и йодиды многих металлов хорошо растворимы в воде. Для определения в растворе хлорид-, бромид- и йодид-ионов используют нитрат серебра. В результате взаимодействия иона серебра и хлорид-иона выпадает белый творожистый осадок хлорида серебра.

В результате взаимодействия иона серебра с бромид-ионом образуется осадок светло-жёлтого цвета.

В реакции иона серебра с йодид-ионом образуется осадок жёлтого цвета.

Для распознавания фторид-иона используют ионы кальция, потому что фторид серебра – это растворимая в воде соль. В результате этой реакции выпадает осадок – фторид кальция – белого цвета.

Дата добавления: 2020-12-11; просмотров: 719;











