Галогены – это элементы VII A группы главной подгруппы.
К ним относятся: фтор, хлор, бром, йод и астат, который очень редко встречается в природе.

Все эти элементы являются типичными неметаллами. Галогены, означает «рождающие соли».
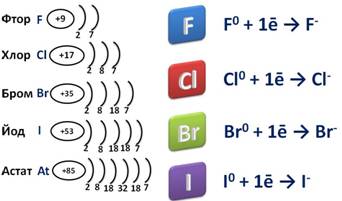
Так как это элементы VII A группы, значит на внешнем энергетическом уровне у них семь электронов. До завершения уровня им не хватает одного электрона, поэтому они берут этот недостающий электрон у атомов металлов, при этом образуется ионное соединение – соль, где степень окисления галогена -1.
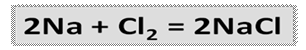
Галогены – сильные окислители, самый сильный из них фтор, который может быть только окислителем и проявлять степень окисления -1.

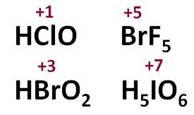
Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательным элементом – фтором, кислородом или азотом. Поэтому для них возможны степени окисления +1, +3, +5, +7. Так, в соединении HClO степень окисления хлора +1, в соединении HBrO2 степень окисления брома +3, в соединении BrF5 степень окисления брома +5, в соединении H5IO6 степень окисления йода +7.
В группе сверху вниз – от фтора к йоду – радиус атома увеличивается, поэтому усиливаются восстановительные и металлические свойства.
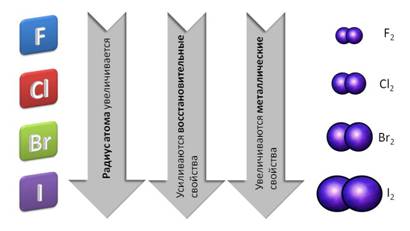
Все галогены представляют собой двухатомные молекулы, связь между атомами – ковалентная полярная. Все галогены имеют молекулярную кристаллическую решётку.
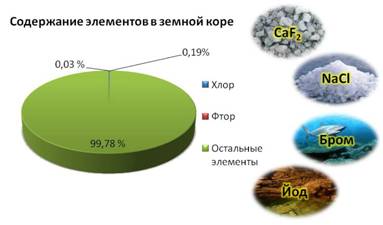
Галогены в природе существуют только в виде соединений с другими элементами. Наиболее распространены хлор и фтор, их содержание составляет 0,19% и 0,03% от массы земной коры.
Например, фтор входит в соcтав плавикового шпата, хлор входит в состав каменной соли, бром содержится в морской воде, а йод в подземных буровых водах.
Рассмотрим таблицу, в которой отражены физические свойства галогенов. Фтор является светло-жёлтым газом, хлор – жёлто-зелёный газ, бром – бурая жидкость, а йод – твёрдое вещество чёрно-серого цвета.




| Вещест-во | Агрегат-ное состоя-ние при н.у. | Цвет | Плот-ность, г/см3 | Температура плавления, 0С | Температура кипения, 0С |
| Фтор F2 | Газ | Светло-жёлтый | 0,0017 | -220 | -188 |
| Хлор Cl2 | Газ | Жёлто-зелёный | 0,0032 | -101 | -34 |
| Бром Br2 | Жидкость | Буровато-коричневый | 3,1 | -7 | +58 |
| Йод I2 | Твёрдое вещество | Чёрно-серый (пары фиолетовые) | 4,9 | +114 | +186 |
Из таблицы видно, что с ростом молекулярной массы увеличиваются температуры кипения и плавления галогенов, их плотность. Это связано, прежде всего, с увеличением размеров атомов и молекул, а, следовательно, и силами межмолекулярного взаимодействия. От фтора к йоду усиливается интенсивность окраски галогенов, а у кристаллов йода появляется металлический блеск.
Дата добавления: 2020-12-11; просмотров: 645;











