Для фтора эта реакция не характерна, потому что он взаимодействует с водой, а эти реакции протекают в растворе.
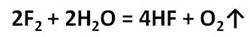
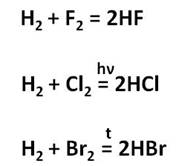
Галогены реагируют с водородом с образованием галогеноводородов. Например, с фтором водород реагирует со взрывом, с хлором – в присутствии света, а с бромом – при нагревании. В результате взаимодействия водорода с фтором образуется фтороводород, в результате взаимодействия водорода с хлором – хлороводород, в результате взаимодействия водорода с бромом – бромоводород.
Получение галогенов оказалось сложным процессом. Например: фтор в свободном виде получен впервые только в 1886 году французским химиком Муассаном, который был удостоен за это Нобелевской премии. Своё название элемент получил от греческого фторос – «разрушающий».


Хлор открыт шведским химиком Шееле в 1774 году. Элемент получил название за цвет простого вещества (от греческого хлорос – жёлто-зелёный).


Бром открыт в 1826 г. французским химиком Баларом. Элемент назван так за запах простого вещества (от греческого бромос – зловонный).


Йод получен в 1811 г. французским учёным Куртуа, а название он получил за цвет паров простого вещества (от греческого иодэс – фиолетовый).


Таким образом, галогены – это элементы VII A группы, их молекулы двухатомны. Они являются сильными окислителями, самый сильный – фтор. Степень окисления фтора – -1, остальные галогены могут иметь степень окисления и +1, +3, +5, +7. В природе встречаются только в виде соединений. Физические свойства их разнообразны: это газы (фтор и хлор), жидкость – бром и твёрдое вещество – йод. С увеличением молекулярной массы у галогенов увеличиваются температуры кипения и плавления. Они вступают во взаимодействие с металлами, с водородом и растворами солей, при этом более активный галоген вытесняет из соли менее активный.
Дата добавления: 2020-12-11; просмотров: 471;











