Нитрифицирующие бактерии
Еще в 1870 г. Шлезинг и Мюнц (Schloesing, Muntz) доказали, что нитрификация имеет биологическую природу. Для этого они добавляли к сточным водам хлороформ. В результате окисление аммиака прекращалось. Однако специфические микроорганизмы, вызывающие этот процесс, были выделены лишь Виноградским. Им же было показано, что хемо-автотрофные нитрификаторы могут быть подразделены на бактерий, осуществляющих первую фазу этого процесса, а именно окисление аммония до азотистой кислоты (NH4+->NO2-), и бактерий второй фазы нитрификации,' переводящих азотистую кислоту в азотную (N02-->NO3-). И те и другие микроорганизмы являются грамотрицательными. Их относят к семейству Nitrobacteriaceae.
Бактерии первой фазы нитрификации представлены четырьмя родами: Nitrosomonas, Nitrosocystis, Nitrosolobus и Nitrosospira. Из них наиболее изучен вид Nitrosomonas euro-раеа, хотя получение чистых культур этих микроорганизмов, как и других нитрифицирующих хемоавтотрофов, до сих пор остается достаточно сложным. Клетки N. еurораеа обычно овальные (0,6—1,0 )< 0,9—2,0 мкм), размножаются бинарным делением. В процессе развития культур в жидкой среде наблюдаются подвижные формы, имеющие один или несколько жгутиков, и неподвижные зооглеи.
У Nitrosocystis oceanus клетки округлые, диаметром 1,8—2,2 мкм, но бывают и крупнее (до 10 мкм). Способны к движению благодаря наличию одного жгутика или пучка жгутиков. Образуют зооглеи и цисты.
Размеры Nitrosolobus multiformis составляют 1,0—1,5 X 1,0—2,5 мкм. Форма этих бактерий не совсем правильная, так как клетки разделены на отсеки, дольки (-lobus, отсюда и название Nitrosolobus), которые образуются в результате разрастания внутрь цитоплазматической мембраны.
У Nitrosospira briensis клетки палочковидные и извитые (0,8 —1,0 X 1,5—2,5 мкм), имеют от одного до шести жгутиков.
Среди бактерий второй фазы нитрификации различают три рода: Nitrobacter, Nitrospina и Nitrococcus.
Большая часть исследований проведена с разными штаммами Nitrobacter, многие из которых могут быть отнесены к Nitrobacter wino-gradskyi, хотя описаны и другие виды. Бактерии имеют преимущественно грушевидную форму клеток. Как показано Г. А. Заварзиным, размножение Nitrobacter происходит путем почкования, причем дочерняя клетка бывает обычно подвижна, так как снабжена одним латерально расположенным жгутиком. Отмечают также сходство Nitrobacter с почкующимися бактериями рода Hyphomicrobium по составу жирных кислот, входящих в липиды.
Данные относительно таких нитрифицирующих бактерий, как Nitrospina gracilis и Nitrococcus mobilis, пока весьма ограниченны. По имеющимся описаниям, клетки N. gracilis палочковидные (0,3—0,4 X 2,7—6,5 мкм), но обнаружены и сферические формы. Бактеррга неподвижны. Напротив, N. mobilis обладает подвижностью. Клетки его округлые, диаметром около 1,5 мкм, с одним-двумя жгутиками.
По строению клеток исследованные нитрифицирующие бактерии похожи на другие грамотрицательные микроорганизмы. У некоторых видов обнаружены развитые системы внутренних мембран, которые образуют стопку в центре клетки (Nitrosocystis oceanus), или располагаются по периферии параллельно цитоплазматической мембране (Nitrosomonas еигораеа), или образуют чашеподобную структуру из нескольких слоев (Nitrobacter winogradskyi). Видимо, с этими образованиями связаны ферменты, участвующие в окислении нитрификаторами специфических субстратов.
Нитрифицирующие бактерии растут на простых минеральных средах, содержащих окисляемый субстрат в виде аммония или нитритов и углекислоту. Источником азота в конструктивных процессах могут быть, кроме аммония, гидроксиламин и нитриты.
Показано также, что Nitrobacter и Nitrosomonas еигораеа восстанавливают нитриты с образованием аммония.
Такой микроорганизм, как Nitrosocystis oceanus, выделенный из Атлантического океана, относится к облигатным галофилам и растет на среде, содержащей морскую воду. Область значений рН, при которой наблюдается рост разных видов и штаммов нитрифицирующих бактерий, приходится на 6,0—8,6, а оптимальное значение рН чаще всего 7,0—7,5. Среди Nitrosomonas еигораеа известны штаммы, имеющие температурный оптимум при 26 или около 40 °С, и штаммы, довольно быстро растущие при 4°С.
Все известные нитрифицирующие бактерии являются облигатными аэробами. Кислород необходим им как для окисления аммония в азотистую кислоту:
NH4++3/2O2 ->N02-+ H20+2H+, дельта F = - 27,6.104d;w:,
так и для окисления азотистой кислоты в азотную:
NO2-+1/2О2 - NO3-, дельта F = -7,6*104дж.
Но весь процесс превращения аммония в нитраты происходит в несколько этапов с образованием соединений, где азот имеет разную степень окисленности.
Первым продуктом окисления аммония является гидроксиламин, который, возможно, образуется в результате непосредственного включения в NH4+ молекулярного кислорода:
NH4+ +1/2 O2 -> NH2OH+H+, дельта F = + 15,9*103дж.
Однако окончательно механизм окисления аммония до гидроксиламина не выяснен. Превращение гидроксиламина в нитрит:
NH2OH+O2 -> N02-+ H20+H+, дельта F = — 28,9 •104 Дж
как предполагают, идет через образование гипонитрита NOH, а также окись азота (N0). Что касается закиси азота (N20), обнаруживаемой при окислении Nitrosomonas europaea аммония и гидроксиламина, то большинство исследователей считает ее побочным продуктом, образующимся в основном в результате восстановления нитрита.
Исследование окисления Nitrobacter нитрита с использованием в опытах тяжелого изотопа кислорода (180) показало, что образующиеся нитраты содержат значительно больше 180, когда меченой является вода, а не молекулярный кислород. Поэтому предполагают, что сначала происходит образование комплекса N02~H2O, который далее окисляется до N0s~. При этом происходит передача электронов через промежуточные акцепторы на кислород. Весь процесс нитрификации можно представить в виде следующей схемы (рис. 137), отдельные этапы которой требуют, однако, уточнения.
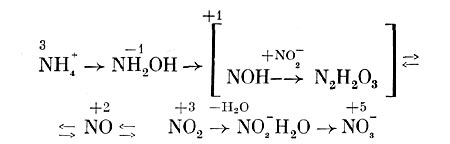
Рис. 131. Структурные формулы некоторых каротиноидов фототрофных бактерий.
Кроме первой реакции, а именно образования из аммония гидроксиламина, последующие стадии обеспечивают организмы энергией в виде аденозинтрифосфата (АТФ). Синтез АТФ сопряжен с функционированием окислительно-восстановительных систем, передающих электроны на кислород, подобно тому как это имеет место у гетеротрофных аэробных организмов. Но поскольку окисляемые нитрификаторами субстраты имеют высокие окислительно-восстановительные потенциалы, они не могут взаимодействовать с никотинамидадениндинуклеотида-ми (НАД или НАДФ, E = —0,320 В), как это бывает при окислении большинства органических соединений. Так, передача электронов в дыхательную цепь от гидроксиламина, видимо, происходит на уровне флавина:
NH2OH -> флавопротеид —> цит. b (убихинон?) —>—> цит. с -> цит. а —> - 02
Когда окисляется нитрит, то включение его электронов в цепь, вероятно, идет на уровне либо цитохрома типа с, либо цитохрома типа а. В связи с этой особенностью большое значение у нитрифицирующих бактерий имеет так называемый обратный, или обращенный, транспорт электронов, идущий с затратой энергии части АТФ или трансмембранного потенциала, образуемых при передаче электронов на кислород (рис. 138).
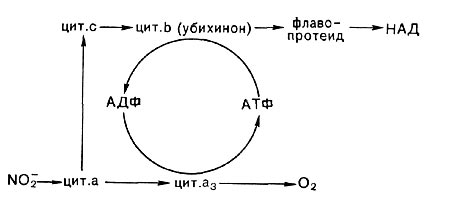
Рис. 132. Схема переноса электронов при фотосинтезе у растений: П, и П2 — пигменты фотоактивных центров; Z, и Z2 — первичные акцепторы электрона; Фд — ферредоксин; НАДФ — никотинамидадениндинуклеотидфосфат; АТФ — аденозинтрифосфат.
Таким образом происходит обеспечение хемо-автотрофных нитрифицирующих бактерий не только АТФ, но и НАДН, необходимых для усвоения углекислоты и для других конструктивных процессов.
Согласно расчетам эффективность использования свободной энергии Nitrobacter может составлять 6,0—50,0%, a Nitrosomonas — и больше.
Ассимиляция углекислоты происходит в основном в результате функционирования пенто-зофосфатного восстановительного цикла углерода, иначе называемого циклом Кальвина (см. рис. 134). Итог его выражают следующим уравнением:
6С02+18АТФ+12НАДН+12Н+ -> -> 6[СН20] + 18АДФ+18Фн+12НАД+6Н20,
где [СН2О] означает образующиеся органические вещества, имеющие уровень восстановлен-ности углеродов. Однако в действительности в результате ассимиляции углекислоты через цикл Кальвина и другие реакции, прежде всего путем карбоксилирования фосфоенолпирувата, образуются не только углеводы, но и все другие компоненты клеток — белки, нуклеиновые кислоты, липиды и т. д. Показано также, что Nitrococcus mobilis и Nitrobacter winogradskyi могут образовывать в качестве запасных продуктов поли-бета-оксибутират и гликогеноподобный полисахарид. Такое же соединение обнаружено в клетках Nitrosolobus multiformis. Кроме углеродсодержащих запасных веществ, нитрифицирующие бактерии способны накапливать полифосфаты, входящие в состав мета-хроматиновых гранул.
Еще в первых работах с нитрификатором Ви-ноградский отметил, что для их роста неблагоприятно присутствие в среде органических веществ, таких, как пептон, глюкоза, мочевина, глицерин и др. Отрицательное действие органических веществ на хемоавтотрофные нитрифицирующие бактерии неоднократно отмечалось и в дальнейшем. Сложилось даже мнение, что эти микроорганизмы вообще не способны использовать экзогенные органические соединения. Поэтому их стали называть «облигатными автотрофами». Однако в последнее время показано, что использовать некоторые органические соединения эти бактерии способны, но возможности их ограничены. Так, отмечено стимулирующее действие на рост Nitro-bacter в присутствии нитрита дрожжевого авто-лизата, пиридоксина, глутамата и серина, если они в низкой концентрации вносятся в среду. Показано также включение в белки и другие компоненты клеток Nitrobacter 14C из пирувата, альфа-кетоглутарата, глутамата и аспартата. Известно, кроме того, что Nitrobacter медленно, по окисляет формиат. Включение 14С из ацетата, пирувата, сукцината и некоторых аминокислот, преимущественно в белковую фракцию, обнаружено при добавлении этих субстратов к суспензиям клеток Nitrosomonas europaea. Ограниченная ассимиляция глюкозы, пирувата, глутамата и аланина установлена для Nitrosocystis oceanus. Есть данные об использовании 14С-ацетата Nitrosolobus multiformis.
Недавно установлено также, что некоторые штаммы Nitrobacter растут на среде с ацетатом и дрожжевым автолизатом не только в присутствии, но и в отсутствие нитрита, хотя и медленно. При наличии нитрита окисление ацетата подавляется, но включение его углерода в разные аминокислоты, белок и другие компоненты клеток увеличивается. Имеются, наконец, данные, что возможен рост Nitrosomonas и Nitrobacter на среде с глюкозой в диализируе-мых условиях, которые обеспечивают удаление продуктов ее метаболизма, оказывающих инги-биторное действие на данные микроорганизмы. На основании этого делается вывод о способности нитрифицирующих бактерий переключаться на гетеротрофный образ жизни. Однако для окончательных выводов необходимо большее число экспериментов. Важно прежде всего выяснить, как долго нитрифицирующие бактерии могут расти в гетеротрофных условиях при отсутствии специфических окисляемых субстратов.
Хемоавтотрофные нитрифицирующие бактерии имеют широкое распространение в природе и встречаются как в почве, так и в разных водоемах. Осуществляемые ими процессы могут происходить весьма в крупных масштабах и имеют существенное значение в круговороте азота в природе. Раньше считали, что деятельность нитрификаторов всегда способствует плодородию почвы, поскольку они переводят аммоний в нитраты, которые легко усваиваются растениями, а также повышают растворимость некоторых минералов. Сейчас, однако, взгляды на значение нитрификации несколько изменились. Во-первых, показано, что растения усваивают аммонийный азот и ионы аммония лучше удерживаются в почве, чем нитраты. Во-вторых, образование нитратов иногда приводит к нежелательному подкислению среды. В-третьих, нитраты могут восстанавливаться в результате денитрификации до N2, что приводит к обеднению почвы азотом.
Следует также отметить, что наряду с нитрифицирующими хемоавтотрофными бактериями известны гетеротрофные микроорганизмы, способные вести близкие процессы. К гетеротрофным нитрификаторам относятся некоторые грибы из рода Fusarmm и бактерии таких родов, как Alcaligenes, Corynebacterium, Achromoba-cter, Pseudomonas, Arthrobacter, Nocardia.
Показано, что Arthrobacter sp. окисляет в присутствии органических субстратов аммоний с образованием гидроксиламина и далее нитритов и нитратов. Кроме того, может образовываться гидроксамовая кислота. У ряда бактерий выявлена способность осуществлять нитрификацию органических азотсодержащих соединений: амидов, аминов, оксимов, гидро-ксаматов, нитросоединений и др. Пути их превращения представляют следующим образом:
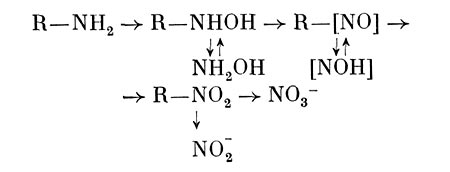
Размеры гетеротрофной нитрификации в некоторых случаях бывают довольно большие. Кроме того, при этом образуются некоторые продукты, обладающие токсичным, канцерогенным, мутагенным действием и соединения с хи-миотерапевтическим эффектом. Поэтому исследованию данного процесса и выяснению его значения для гетеротрофных микроорганизмов сейчас уделяют значительное внимание.
Дата добавления: 2020-11-18; просмотров: 610;











