Морфология строение клеток и систематика
Всего сейчас описано около пятидесяти видов пурпурных и зеленых бактерий. Многие из них выделены в виде чистых культур, или монокультур. В морфологическом отношении фото-трофные бактерии проявляют значительное разнообразие. Среди них есть сферические, палочковидные и извитые формы, а также организмы, клетки которых имеют выросты (рис. 122, 123, 124). Некоторые фототрофные бактерии, особенно часто в природных условиях, образуют различные, иногда весьма характерные скопления (агрегаты) клеток в виде цепочек и пластинок, нередко заключенных в слизь. Размеры фототрофных бактерий также весьма различные, от 1—2 мкм в диаметре до 50 мкм и более в длину. Наиболее крупные формы встречаются среди пурпурных серобактерий. К ним относятся такие организмы, как Chroniatium okenii и Thiospirillum jenense. Есть подвижные и неподвижные виды. У большинства движение обусловлено наличием одного или нескольких жгутиков, расположенных полярно. Лишь у одного вида пурпурных бактерий (Rhodomicrobium vannielii) жгутикование перитрихиальное. Подвижные пурпурные бактерии способны к фототаксису, аэротаксису и хемотаксису, т. е. к движению, вызванному светом, кислородом или некоторыми химическими соединениями. В зависимости от направления движения эти реакции могут быть положительными или отрицательными. Большинство фототрофных бактерий размножается бинарным делением. Но для некоторых видов пурпурных бактерий (Rhodomicrobium vannielii, Rhodopseudomonas palustris, Rh. viridis, Rh. acidophila) характерно почкование. Эндоспор фототрофные бактерии не образуют. По Граму красятся отрицательно.
При изучении строения этих микроорганизмов на ультратонких срезах с помощью электронной микроскопии обычно легко обнаружить в клетках нуклеоид. Кроме того, они содержат развитую систему мембран, некоторые из них выполняют функцию фотосинтезирующего аппарата, У разных видов эти образования, называемые хроматофорами или тилакоидами, неодинаковы и могут иметь форму пузырьков, трубочек или пластинок, иногда правильных стопок (рис. 125, 126, 127). Для пурпурных бактерий показано, что хроматофоры возникают в результате разрастания внутрь клеток цито-плазматической мембраны и бывают с ней связаны. В отношении происхождения фотосинтезирующего аппарата зеленых бактерий столь четких данных нет. Образование и отчасти форма фотосинтезирующих структур зависят от условий роста бактерий, в первую очередь от наличия света и кислорода. В клетках некоторых пурпурных и зеленых бактерий (Thiodictyon, Amoebobacter, Thiopedia, Pelodictyon) имеются газовые вакуоли, иначе называемые аэросомами. Предполагают, что они помогают микроорганизмам находиться во взвешенном состоянии. Фототрофные бактерии могут накапливать полифосфаты, образующие особые гранулы. Кроме того, в клетках пурпурных бактерий часто обнаруживаются гранулы, состоящие из поли-3-оксимасляной кислоты, которая является запасным продуктом. При соответствующей окраске можно обнаружить также накопление запасных полисахаридов. Большинство пурпурных серобактерий способно откладывать в клетках серу в виде одной или нескольких капель.
Согласно новой классификации, пурпурные и зеленые бактерии объединяются в порядок Rhodospirillales, включающий два подпорядка: Rhodospirillineae и Chlorobiineae. Первый из них представляет пурпурных, а второй зеленых бактерий. Такое подразделение основано на определенных различиях в составе хлоро-филлов, образуемых этими микроорганизмами, и коррелирует с другими их свойствами. Под-порядок Rhodospirillineae состоит из двух семейств: Rhodospirillaceae и Chromatiaceae. Семейство Rhodospirillaceae объединяет микроорганизмы, широко известные под названием несерных пурпурных бактерий, а семейство Chromatiaceae — микроорганизмы, называемые пурпурными серными бактериями или пурпурными серобактериями. Это деление основано на некоторых различиях их физиологических свойств, в первую очередь на отношении к сероводороду.
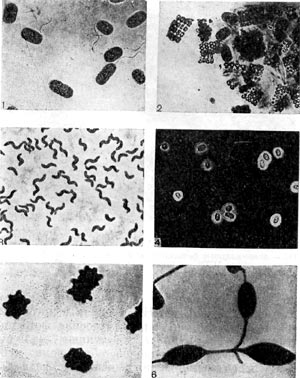
Рис. 124. Микрофотографии разных видов фототрофных бактерий. Снимки 1 — 4 сделаны в световом микроскопе, а снимки 5 — 6 — в электронном микроскопе.
Подпорядок Chlorobiineae представлен пока одним семейством — Chlorobiaceae. Эти микроорганизмы обычно называют зелеными серными бактериями или зелеными серобактериями. Подобно пурпурным серобактериям все представители данного семейства способны окислять сероводород. Лишь недавно выделены зеленые бактерии (Chloroflexis), для которых потребность в сероводороде и других восстановленных соединениях серы не установлена. Поэтому к семейству Chlorobiaceae их отнести нельзя.
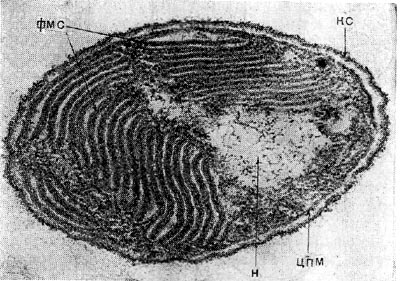
Рис. 125. Ультратонкие срезы клеток Ectothiorhodospiга shaposhnikovii. КС — клеточная стенка, ЦПМ — цитоплазматическая мембрана, Н — нуклеоид, ФМС — фотосинтезирующие мембранные структуры. Увел. X 40 000.
На основании главным образом морфологических признаков каждое из семейств фототроф-ных бактерий подразделяется на ряд родов. Основы такой классификации были заложены еще в 1888 г. С. Н. Виноградским и с некоторыми изменениями сохранились до настоящего времени.
При определении отдельных видов, кроме морфологии, как правило, изучают состав не только хлорофиллов, но и каротиноидов. Определяют содержание в ДНК гуанина и цитозина (Г + Ц мол. %), исследуют строение фотосинтезирующего аппарата, выясняют наличие в клетках газовых вакуолей, образование капсул, способ размножения и основные физиологические свойства.
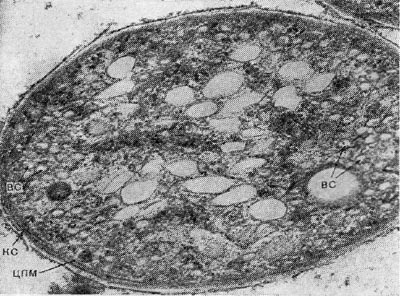
Рис. 126. Ультратонкие срезы клеток Amoebobacter sp. BG — везикулярные фотосинтезирующие структуры; КС — клеточная стенка; ЦПМ — цитоплазматическая мембрана. Увел. X 40 000.
Всего сейчас насчитывают 20 родов фототроф-ных бактерий, представители некоторых, включенные в последние определители, перечисляются ниже.
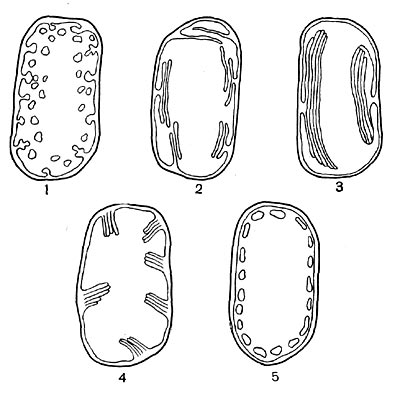
Рис. 127. Типы фотосинтезирующего аппарата у фототрофных бактерий: 1—4 — у пурпурных бактерий, 5 — у зеленых серобактерий.
Семейство Rhodospirillaceae — несерные пурпурные бактерии, состоит из 4 родов и 13 видов.
Род Rhodospirillum включает 5 видов (R. rub-rum, R. tenue, R. fulvum, R. molischianum, R. photometricum). Из них наиболее известен вид R. rubrum. Все представители данного рода имеют извитую форму клеток, но размеры их разные. Подвижны.
Род Rhodopseudomonas объединяет пурпурных бактерий, клетки которых имеют палочковидную, овальную или сферическую форму (0,5 —1,3 X 1,0—5,0 мкм). Описано 6 видов (Rh. palustris, Rh. gelatinosa, Rh. spheroides, Rh. capsulata, Rh. acidophila, Rh. viridis). Bee представители подвижны.
Род Rhodomicrobium имеет один вид почкующихся бактерий R. vannielii. Недавно выделены пурпурные бактерии, отнесенные к новому роду — Rhodocyclus; они названы Rh. purpureus.
Семейство Chromatiaceae — пурпурные серобактерии, включает 10 родов и 26 видов. Эти роды следующие: Chromatium, Thiospirilium, Thiocystis, Thiocapsa, Thiopedia, Thiosarcina, Lamprocystis, Thiodictyon, Amoebobacter и Ectothiorhodospira. Наиболее изучены некоторые представители рода Chromatium, которых всего известно 9 (Chr. okenii, Chr. weissei, Chr. warmingii, Chr. buderi, Chr. minus, Chr. violascens, Chr. gracile, Chr. vinosum, Chr. minutissimum).
Эти микроорганизмы имеют овальную или палочковидную форму и образуют жгутики. Отдельные виды различаются между собой размерами и формой клеток, составом каротиноидов и некоторыми физиологическими свойствами. Как уже отмечалось выше, среди них есть очень крупные микроорганизмы, такие, как Chr. okenii (5,0—6,0 х 7,0—15,0 мкм), но есть и значительно меньше (Chr. minutissimum).
Интересными формами являются бактерии рода Thiospirilium. Среди этих извитых бактерий также есть очень крупные микроорганизмы. Выделяют три вида (Т. jenense, T. san-guineum, T. rosenbergii). Наиболее известен вид Т. jenense. Клетки Т. jenense могут достигать 40, а иногда и 100 мкм в длину. Бактерии подвижны. К подвижным пурпурным серобактериям относятся и представители такого рода, как Thiocystis (T. violacea, T. gelatinosa), имеющие сферическую или овальную форму. Иногда они образуют агрегаты клеток, окруженные слизью. Характерным признаком Thiosarcina (Т. rosea) является образование скоплений клеток (от 8 до 64) в виде правильных пакетов. Отдельные клетки сферические. К сферическим формам относятся и представители рода Thiocapsa (T. pfennigii, T. roseopersicina). Эти бактерии неподвижны.
Среди пурпурных серобактерий, образующих газовые вакуоли, подвижность обнаружена только у Lamprocystis (L. roseopersicina), которая имеет сферические или овальные клетки со жгутиками. Бактерии рода Thiodictyon — палочковидные и могут объединяться в сетчатые структуры. Описано два вида (Т. elegans и Т. bacillosum). Род Thiopedia представлен одним видом (Т. rosea). Представители рода Amoebobacter (A. roseus, A. pendens), как и Thiopedia, имеют овальные или сферические клетки. Отличительной чертой этих бактерий является образование больших слизистых капсул. Все перечисленные пурпурные серобактерии при окислении сероводорода или некоторых других восстановленных соединений серы откладывают в клетках серу. В отличие от этого представители рода Ectothiorhodospira (E. mobilis, E. halophila, E. shaposhnikovii) накапливают серу в среде. Все три вида Ectothiorhodospira представляют собой палочки, часто изогнутые (0,7 — 1,0 X 2,0—5,0 мкм), подвижны. Типовым видом является E. mobilis.
Семейство Chlorobiaceae — зеленые серобактерии, насчитывает 5 родов и 9 видов. Наиболее известны представители рода Chlorobium, к которому относят 4 вида и две разновидности (С. Hmicola, С. limicola forma thiosulfatophi-lum, C. vibrioforme, С. vibrioforme forma thiosulfatophilum, C. phaeobacteroides, C. phaeo-vibrioides).
Это неподвижные палочки или вибриоидные формы размером 0,3 — 0,8 х 1,0 — 3,0 мкм. Такой организм, как С. limicola, часто образует цепочки клеток. Для зеленых бактерий рода Pelodictyon (P. clathratiforme, P. luteolum) показана способность к образованию агрегатов клеток, которые у P. clathratiforme имеют форму сетчатых структур. Отдельные клетки овальные или палочковидные и способны к ветвлению.
Бактерии, отнесенные к роду Prosthecochloris (P. aestuarii), отличаются тем, что клетки их имеют выросты (простеки), но по физиологическим свойствам похожи на Chlorobium. Наличие длинных выростов характерно также для зеленых бактерий, выделенных в особый род Ancalochloris (A. perfilievii). P. aestuarii и A. perfilievii впервые описаны В. М. Горленко. Последний род зеленых серобактерий представлен мало исследованным организмом Clathrachloris sulfurica, который наблюдали только в природном материале и в накопительных культурах.
Следует также отметить, что к подпорядку Chlorobiineae сейчас относят и такие микроорганизмы, как Chloroflexis. Известно два штамма этих бактерий: F - 1 и F - 2. Видовые названия еще не даны.
Физиология
Большинство пурпурных серобактерий — строгие анаэробы и облигатные фототрофы, т. е. рост их возможен только при освещении. Известно лишь три вида, растущие в присутствии воздуха, причем не только на свету, но и в темноте, хотя и медленно. Это — A. roseus, Е. shaposhnikovii и Т. roseopersicina. Все несерные пурпурные бактерии также растут в анаэробных условиях, но в основном являются факультативными аэробами. До недавнего времени считали, что рост пурпурных бактерий в темноте возможен лишь в аэробных или микроаэрофильных условиях, так как в отсутствие света они получают энергию в процессе дыхания. Однако недавно установлено, что R. rubrum и ряд представителей Rhodopseudomonas растут в темноте и в строго анаэробных условиях за счет сбраживания некоторых органических субстратов. Такую же возможность, видимо, имеют пурпурные серобактерии Е. shaposhnikovii и Т. roseopersicina.
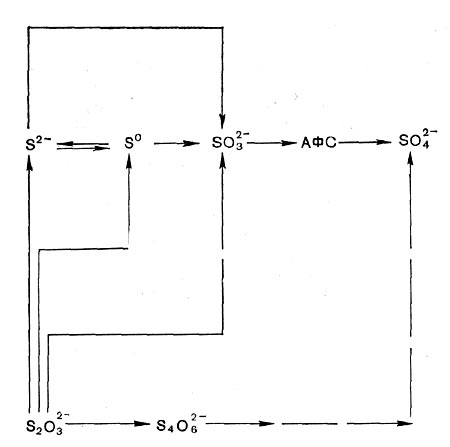
Рис. 128. Пути окисления соединений серы фототрофными бактериями АФС — аденилнлсульфат.
Зеленые бактерии — строгие анаэробы и облигатные фототрофы. Исключением являются представители рода Chloroflexis. Они растут только в аэробных условиях, причем и при освещении и в темноте. Однако даже фототроф-ные бактерии, хорошо растущие в темноте, лучше развиваются при наличии света. В зависимости от организма оптимальные условия освещения для его роста могут быть различны. Одни виды хорошо растут при слабом освещении (100—300 лк), другие — при более сильном свете (700—2000 лк).
Хотя неоднократно отмечалось развитие фо-тотрофных бактерий в горячих источниках с температурой воды 60—80 °С, ни одного обли-гатно термофильного вида до сих пор не выделено. Оптимальная температура для роста многих видов этих микроорганизмов в лабораторных условиях — 25—35 °С. Только Е. halo-phila имеет температурный оптимум около 47 °С. В то же время известны пурпурные и зеленые серобактерии (Thiopedia, Lamprocystis, Pelodictyon), хорошо растущие при температуре не выше 20 °С.
Фототрофные бактерии в целом могут расти в достаточно широком интервале значений рН, примерно от 5,0 до 11,0, хотя для отдельных видов и штаммов оптимальное значение рН и зона, в которой возможен их рост, могут существенно различаться. Для многих представителей пурпурных и зеленых бактерий оптимальное значение рН 7,0—7,5. Но известны виды, для которых оптимально значение рН 6,0—6,5. Для Rh. acidophila оно составляет даже 5,8. Напротив, некоторые штаммы Е. shaposhnikovii хорошо растут при рН 8,5 — 9,0. Показано также, что оптимальное значение рН для роста фототрофных бактерий может несколько меняться в зависимости от состава среды.
Все фототрофные бактерии растут на простых синтетических средах, что облегчает выявление их потребности в отдельных элементах. Обязательными компонентами сред, кроме источников углерода и азота, естественно, являются фосфор, сера, калий и магний в виде минеральных солей. Установлено также, что эти микроорганизмы нуждаются в довольно большом количестве железа, но по сравнению с растениями проявляют значительно меньшую потребность в марганце. Рост их зависит от концентрации кальция и наличия в небольших количествах таких элементов, как Mo, Co, Zn, Си и, видимо, других.
Выше отмечалось, что фототрофные бактерии встречаются как в пресных, так и в соленых водоемах, причем некоторые пурпурные бактерии растут при концентрации хлористого натрия больше 20%. Наиболее галофильной формой является Е. halophila. Оптимальная концентрация NaCl для этого организма 14—22%. Для других видов, даже выделенных из очень соленых водоемов, она более низкая. Зеленые бактерии растут при концентрации NaCl не, более 10—11%. И для пурпурных и зеленых бактерий, выделенных из соленых водоемов, присутствие NaCl обязательно. Так, морские штаммы растут обычно хорошо в среде, содержащей 1—2% NaCl.
За исключением отдельных мутантов, все фототрофные бактерии используют в качестве источника азота соли аммония. Способность к ассимиляционной нитратредукции проявляется довольно редко. Некоторые пурпурные бактерии, в первую очередь несерные, используют как источники азота мочевину и различные аминокислоты, а также растут на средах с пептоном. У многих пурпурных и зеленых бактерий установлена способность фиксировать молекулярный азот.
В качестве источника серы для синтеза серу-содержащих компонентов клеток несерные пурпурные бактерии и некоторые пурпурные серобактерии могут использовать сульфаты. Однако многие представители пурпурных серобактерий и зеленые серобактерии способностью к ассимиляционной сульфатредукции не обладают и могут использовать серу лишь в восстановленной форме, в виде сульфида, тиосульфата или цистеина.
Кроме того, пурпурные и зеленые серобактерии используют восстановленные соединения серы как доноры водорода (Н-доноры) при фотоассимиляции углекислоты. Все эти микроорганизмы способны окислять сероводород с образованием сульфатов, но сначала образуется молекулярная сера (рис. 128). У большинства пурпурных серобактерий сера откладывается в клетках. Зеленые серобактерии и представители рода Ectothiorhodospira накапливают серу в среде. Кроме сульфида и молекулярной серы, многие пурпурные и зеленые серобактерии окисляют тиосульфат, а некоторые виды тетра-тионат, сульфит и тиогликолят.
До последнего времени считали, что несерные пурпурные бактерии сероводород не окисляют и лишь для одного вида (Rh. palustris) была показана способность окислять тиосульфат. Однако недавно установлено, что если поддерживать низкую концентрацию сульфида в проточных условиях культивирования, то такие несерные пурпурные бактерии, как R. rubrum, Rh. capsulata, Rh. palustris, Rh. spheroides, окисляют его и растут. При этом Rh. palustris образует сульфаты. У остальных видов окисление сульфида заканчивается образованием молекулярной серы, которая обнаруживается в среде.
Эти данные весьма важны, поскольку до сих пор деление пурпурных бактерий на серные и несерные основывалось на их способности окислять сероводород. Сейчас такой принцип оказывается неприемлемым. Поэтому предлагается учитывать, что пурпурные серобактерии окисляют сероводород до сульфатов через образование молекулярной серы, а несерные пурпурные бактерии окисляют его только до серы или до сульфатов, но без накопления серы как промежуточного продукта. Не исключено, однако, что в дальнейшем эти критерии также нельзя будет использовать.
Кроме соединений серы, многие пурпурные и зеленые бактерии способны окислять молекулярный водород.
Большинство представителей несерных пурпурных бактерий нуждается в одном или нескольких витаминах группы В: тиамине, биотине, никотиновой, параминобензойной кислотах. Потребность в витаминах не выявлена лишь у Rhodomicrobium vannielii, Rh. acidophila и Rhodospirillum tenue. Среди пурпурных и зеленых серобактерий значительно больше организмов, которые не нуждаются в витаминах.
Однако есть виды и штаммы, требующие готового витамина В12. Такую потребность проявляют, например, крупные формы Chromatium (Chr. okenii, Chr. buderi и другие), а также Thiospirillum jenense.
Фотосинтезирующие бактерии делят на фотоавтотрофы и фотогетеротрофы. К первым принадлежит ряд пурпурных и зеленых серобактерий, а также отдельные представители несерных пурпурных бактерий, способные расти на чисто минеральных средах. Для таких микроорганизмов единственным источником углерода может служить углекислота, обычно вносимая в виде бикарбоната. К фотогетеротро-фам относят большинство несерных пурпурных бактерий, поскольку они растут лишь при наличии органических соединений. Строго говоря, к автотрофам нельзя причислять и фото-синтезирующих бактерий, которые нуждаются в готовых витаминах. С другой стороны, следует отметить, что фотогетеротрофные бактерии часто фиксируют в больших количествах углекислоту. В то же время все автотрофные представители этих микроорганизмов способны использовать готовые органические соединения, хотя возможности в этом отношении у разных видов неодинаковы.
Более разнообразные органические соединения могут использовать несерные пурпурные бактерии. К их числу относятся низшие жирные кислоты от С3 (муравьиная) до С9 (пеларгоновая), дикарбоновые кислоты, окси- и кетокислоты (от С3 до С6), такие, как пировиноградная, молочная, яблочная, янтарная и др.
Используются некоторые сахара (в частности, глюкоза, фруктоза, манноза), спирты (этанол, изопропанол, маннит, сорбит), соединения ароматического ряда (бензоат, пара-оксибензоат, манделат, катехин), а также другие циклические соединения. Однако спектр органических субстратов, обеспечивающих рост различных видов и штаммов этих микроорганизмов, неодинаков.
Пурпурные и особенно зеленые серобактерии, как правило, используют меньшее число органических соединений; чаще всего отдельные органические кислоты. У некоторых видов возможности исчерпываются потреблением ацетата и пирувата.
Для несерных и некоторых пурпурных серобактерий (Е. shaposhnikovii, Chr. vinosum) органические соединения могут служить источниками углерода и Н-донорами при фотоассимиляции углекислоты, а также в других восстановительных процессах. Ряд видов способен в темноте окислять органические соединения с получением энергии, обеспечивающей их рост. У зеленых и многих пурпурных серобактерий способности ограничиваются использованием органических соединений при фотосинтезе лишь как дополнительных (по отношению к С02) источников углерода.
Фотосинтез
Способность фототрофных бактерий к фотосинтезу, как и у растений, определяется наличием магнийсодержащих порфириновых пигментов — хлорофиллов. Состав бактериальных хлорофиллов, называемых бактериохлорофил-лами, отличается от хлорофиллов растений (рис. 129). Наиболее распространен бактерио-хлорофилл a1 этерифицированный, как и хлорофилл а растений, фитолом. Но он отличается от этого пигмента тем, что во втором положении первого пиррольного кольца содержит ацетильную группу вместо винильной, а второе пир-рольное кольцо его восстановлено. Кроме этого пигмента, у R. rubrum обнаружен бактериохло-рофилл ag, этерифицированный транс, транс-геранилгераниолом (С20Н33ОН). У двух пурпурных бактерий (Thiocapsa pfennigii и Rhodopseudomonas viridis) найден так называемый бактериохлорофилл b. Формула его еще не установлена, но по спектральным свойствам он отличается от всех других хлорофиллов. Зеленые бактерии в небольшом количестве содержат бактериохлорофилл а. Но основными их пигментами являются бактериохлорофил-лы с и d, содержащие вместо фитола (С20Н39ОН) транс, трансфарнезол (С15Н25ОН). Каждый из этих хлорофиллов состоит из компонентов, различающихся радикалами в положениях 4, 5 и d.
По сравнению с хлорофиллами растений бактериохлорофиллы, особенно в клетках, поглощают свет в более длинноволновой области. Зеленые бактерии абсорбируют свет примерно до 850 нм, пурпурные бактерии, содержащие бактериохлорофиллы а,— до 900 нм, а пурпурные бактерии, синтезирующие бактериохлорофилл b,— до 1100 нм. При этом в инфракрасной области бактериохлорофиллы in vivo обусловливают, как правило, не один, а несколько максимумов поглощения (рис. 130).
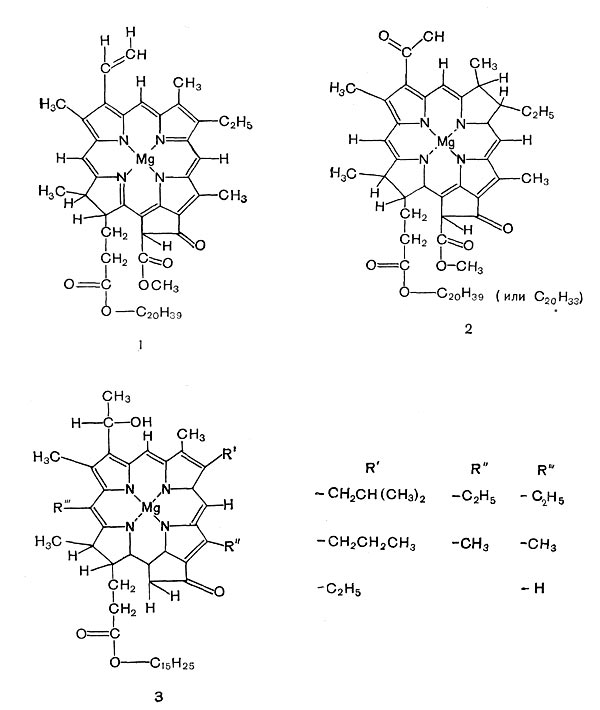
Рис. 129. Структурные формулы хлорофилла а и бактериохлорофиллов: 1 — хлорофилл растений; 2,3 — бактериохлорофиллы.
Наличие максимумов поглощения бактерио-хлорофиллов в области 800—1100 нм обеспечивает возможность роста фототрофных бактерий, особенно пурпурных, при наличии только невидимых инфракрасных лучей. Этим пользуются для получения накопительных культур данных микроорганизмов и разделения видов, содержащих бактериохлорофиллы а и b.
Различия в спектрах поглощения отдельных представителей фототрофных бактерий, а также фототрофных бактерий и растений имеют экологическое значение, позволяя развиваться им в одних и тех же местах.
Кроме хлорофиллов, все фототрофные бактерии содержат каротиноиды, состав которых у разных видов неодинаков и достаточно разнообразен. Всего к настоящему времени у фототрофных бактерий обнаружено около шестидесяти каротиноидов, причем некоторые из них у других организмов не встречаются. Для большинства пурпурных бактерий характерно наличие алифатических каротиноидов, содержащих часто гидроксильные, метоксильные или кетогруппы. Это — ликопин, спириллоксантин, родивибрин, родопин, сфероиден, сфероиденон и другие близкие пигменты. Некоторые пурпурные бактерии синтезируют каротиноиды, имеющие одну арильную группу (ароматическое кольцо). К их числу принадлежит окенон. Но лишь у R. vannielii и Rh. acidophila найден в-каротин, распространенный у сине-зеленых водорослей и других фотосинтезирующих и нефотосинтезирующих организмов. У Rh. acidophila значительная часть родопина и родопинала связана с глюкозой и находится в форме гликозидов.
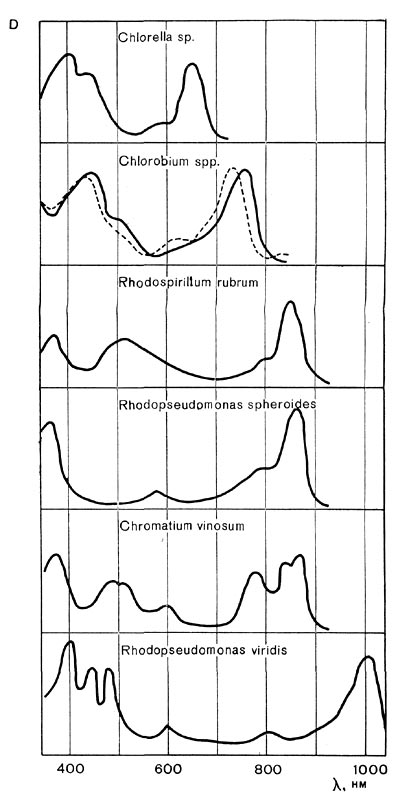
Рис. 130. Спектры поглощения клеток водорослей (Chlorella), зеленых и пурпурных бактерий.
У большинства зеленых серобактерий основным каротиноидом является моноциклическое соединение с ароматическим кольцом, названное хлоробактином. Но некоторые представители этих микроорганизмов синтезируют изорениератин, имеющий два ароматических кольца (рис. 131). Кроме того, у зеленых серобактерий в небольшом количестве находят гамма-каротин, ликопин и родопин.
Интересен состав каротиноидов у недавно выделенных скользящих микроорганизмов рода Chloroflexis, которые, подобно многим зеленым бактериям, содержат бактериохлорофиллы а и с. У Chloroflexis sp. штамм F-2 установлено 9 таких пигментов. В наибольшем количестве содержатся р-каротин, гамма-каротин и перацетил-0-гликозил-1'-окси-1', 2'-дигидро-3', 4'-дигидро-у-каротин. В числе других каротиноидов выделен эхиненон, присутствующий у сине-зеленых водорослей.
Состав и содержание отдельных каротиноидов определяют в основном цвет культур пурпурных бактерий, который бывает розовым, красным, фиолетовым, желтым или почти коричневым. В какой-то степени от состава каротиноидов зависит окраска зеленых бактерий. Она может быть не только зеленой, но желтоватой или коричневой. Показано, что каротиноиды у фототрофных бактерий могут выполнять следующие функции: 1) участвовать в фотосинтезе, поглощая свет в пределах 400—550 нм и передавая энергию возбужденных состояний молекулам бактериохлорофилла; 2) вызывать фототаксис; 3) защищать клетки от фотосенсибилизированного окисления кислородом. Не исключено, однако, что функции этих пигментов до конца не выяснены. Как и хлорофиллы, каротиноиды фототрофных бактерий локализуются в их фотосинтезирующем аппарате — хроматофорах. Кроме того, эти образования содержат ряд соединений, способных выполнять функцию переносчиков электронов (водорода) и характеризующихся разными окислительно-восстановительными потенциалами.
К ним относятся в первую очередь цитохромы, а также хиноны, флавины, никотинамид — дениннуклеотиды и некоторые другие компоненты клеток.
Фотосинтез начинается с поглощения квантов света молекулами хлорофилла и другими связанными с ним пигментами. Молекула пигмента, получившая квант света, переходит в возбужденное состояние, которое длится очень недолго (10/-9 сек) и заканчивается возвращением ее к исходному, стабильному уровню. Этот переход сопровождается либо передачей возбужденного состояния другой молекуле пигмента, либо потерей сообщенной энергии в виде тепла, флуоресценции и фосфоресценции. При миграции энергии электронных возбужденных состояний по пигментному комплексу она может частично достичь так называемых реакционных фотохимических центров. В такие центры входят молекулы хлорофилла и связанные с ними переносчики электронов. Их принято обозначать буквой П с указанием той длины волны, где они сами обусловливают поглощение света. У пурпурных бактерий пигменты, входящие в фотохимические центры, обозначают как П970, или П890, или П895, а у зеленых бактерий — П840. Таким образом, большинство молекул хлорофилла только «абсорбируют» лучистую энергию, а за ее использование для фотосинтеза ответственна лишь небольшая их часть. Расчеты показывают, что на одну .молекулу бактериохлорофилла, входящего в реакционный центр, приходится 25—50 других молекул этого пигмента. Для растений это соотношение еще меньше (1 : 250—400).
Возбужденная молекула пигмента фотоактивного центра (П*) может отдавать электрон связанному с ней первичному акцептору (А) и окисляться. Но в результате немедленного взаимодействия с донором электрона (В) она возвращается в исходное состояние (П):
П+hn -> П* П*+А -> П* + А- П++В -> П+В+
Природа первичного акцептора электрона ни у бактерий, ни у растений точно до сих пор не установлена. Что касается донора электрона, взаимодействующего с П, то, по всем данным, у бактерий — это цитохром типа с.
Фотохимическая стадия фотосинтеза обеспечивает поднятие электрона на высокий энергетический уровень и начало транспорта его через ряд переносчиков с постепенно снижающимися окислительно-восстановительными потенциалами. Перенос электрона может происходить по циклическому и нециклическому пути. В первом случае он возвращается к исходному донору, т. е. к пигменту фотоактивного центра; при втором этого не происходит. Поэтому для поддержания нециклического транспорта электронов необходим экзогенный Н-донор, который восполняет их потерю.
Обе такие системы функционируют при фотосинтезе у растений (рис. 132). Перенос электрона по циклическому пути, как и в дыхательной цепочке, сопряжен с синтезом АТФ. Механизм этих процессов, видимо, одинаков. В результате транспорта электронов по нециклическому пути, кроме АТФ, происходит образование восстановителей, исцользуемых при ассимиляции углекислоты и других соединений. Эту функцию выполняют восстановленный ферредоксин и никотинамидадениндинуклеотиды (НАДН и НАДФН). АТФ и указанные восстановители рассматриваются как первые стабильные продукты фотосинтеза, которые иногда называют «ассимиляционной силой».
При бактериальном фотосинтезе также имеет место циклический путь переноса электронов, сопряженный с образованием АТФ. Но способ образования восстановителей не вполне ясен. Не исключено, что их образование, как и у растений, происходит в результате функционирования нециклической фотосинтетической системы транспорта электронов. Однако ряд данных свидетельствует о том, что бактерии могут восстанавливать НАД в результате так называемого обратного или обращенного переноса электрона без непосредственного участия пигмента фотохимического центра (рис. 133).
Энергия, необходимая для такого переноса электрона против термодинамического градиента, может обеспечиваться затратой части АТФ или непосредственно за счет энергии трансмембранного потенциала, образование которого сопряжено с циклическим транспортом электрона (рис. 133). Возможно, реализуются оба пути.
Каковы бы ни были способы образования восстановителей при бактериальном фотосинтезе, очевидно, что для этого, как и у растений, требуется экзогенный Н-донор.
В результате изучения фотосинтеза у бактерий и сравнения его с фотосинтезом у растений Ван-Ниль показал, что итог этих процессов может быть выражен одним общим уравнением
свет С02+2Н2А -> (СН20)+НаО+2А,
где H2А — донор водорода (электронов), а (СH2О) — символ образуемых органических веществ.
Природа Н2А может быть разной. У растений такую функцию выполняет вода. Поэтому фотосинтез сопровождается выделением кислорода:
свет С02+2Н20 -> (СН20)+Н20+02
У бактерий Н-донором служат сероводород, сера, тиосульфат, молекулярный водород или органические соединения. Поэтому кислород не выделяется, а накапливаются продукты их окисления:
свет 2C02+H2S+2H20 -> 2(CH20)+H2S04
свет С02+2Н2 -> (СН20) + Н20
свет С02+СН3СНОНСН3 -> (СН20)+СН3СОСН3
Такое различие в природе Н-донора отражается на начальных стадиях фотосинтеза. Поскольку бактерии используют в качестве Н-донора достаточно восстановленные соединения, то для использования их электронов на восстановление НАД хватает поглощения одного кванта света. При использовании в качестве Н-донора воды требуется затратить больше энергии, чтобы поднять ее электрон до уровня ферредоксина и НАДФ. Поэтому при фотосинтезе у растений имеют место по крайней мере две фотохимические реакции, которые осуществляются последовательно в разных пигментных системах, различающихся по поглощению света. При бактериальном фотосинтезе, видимо, имеет место только одна фотохимическая реакция и действует одна пигментная система. В результате также происходит преобразование энергии света в энергию химических связей.
Поскольку фотосинтез начали изучать у высших растений, сложилось мнение, что он заключается в синтезе из углекислоты преимущественно углеводов. Сейчас стало очевидным, что первичные стабильные продукты фотосинтеза используются для усвоения и других соединений и могут образовываться разные продукты. Однако это не противоречит тому, что по своим масштабам фотоассимиляция углекислоты превосходит все другие процессы, идущие за счет использования лучистой энергии. Ассимилировать углекислоту способны все фототрофные организмы, но не для всех она может служить единственным источником углерода. Примером, как указывалось выше, служат некоторые пурпурные бактерии.
Основной путь усвоения углекислоты растениями связан с функционированием пентозофос-фатного восстановительного цикла углерода, известного под названием цикла Кальвина (рис. 134). При этом углекислота фиксируется на рибулозодифосфате с образованием 3-фос-фоглицериновой кислоты, а затем фосфорных эфиров Сахаров. Кроме такого механизма, у некоторых растений, происходящих из тропических областей (сахарного тростника, кукурузы и ряда других), установлено наличие особого цикла, названного циклом С4-дикарбоновых кислот или в-карбоксилирования. В данном случае углекислота фиксируется на фосфоенолпирувате с образованием оксалоацетата и далее малата и аспартата. Малат затем, видимо, декарбоксилируется и передает углекислоту в цикле Кальвина. Таким образом, цикл С4-дикарбоновых кислот имеет вспомогательное значение, обеспечивая более эффективный фотосинтез, особенно в условиях невысокого содержания углекислоты.
Цикл Кальвина функционирует и у различных представителей пурпурных бактерий, как серных, так и несерных. Есть данные, что специфические ферменты цикла Кальвина содержат и некоторые зеленые бактерии, однако не все. У некоторых штаммов С. limicola не удалось обнаружить рибулозодифосфаткарбоксилазу — ключевой фермент этого цикла, катализирующего фиксацию СОг на рибулозо-1,5-фосфате.
В то же время есть данные, что у зеленых бактерий, а также у некоторых пурпурных бактерий (R. rubrum) может функционировать особый путь ассимиляции углекислоты, названный восстановительным циклом карбоновых кислот или циклом Арнона (рис. 135). В этом цикле углекислота фиксируется на органических кислотах, причем две реакции, а именно карбоксилирование ацетил-КоА и сукцинил-КоА, происходят при участии восстановленного ферредоксина. В последнее время, однако, появились сомнения относительно возможности функционирования полного цикла Арнона, поскольку у некоторых зеленых и пурпурных бактерий не удалось показать превращения цитрата в оксалоацетат и ацетил-КоА, без чего данный механизм функционировать не может. Но, несомненно, реакции карбоксилирования, входящие в этот цикл, имеют место. Фототрофные бактерии проявляют способность и к другим реакциям карбоксилирования, общее число которых, видимо, больше, чем у растений. Многие представители этих микроорганизмов, например, способны карбоксилировать пируват и фосфоенолпируват, образуя оксалоацетат или малат. У нескольких видов показана возможность карбоксилирования пропионнл-КоА с образованием либо метилмалонил-КоА и далее сукцината, либо a-кетобутирата.
У всех известных представителей фототроф-ных бактерий проявляется способность к фотоассимиляции органических соединений: ацетата, пирувата, а иногда также пропионата, сукцината, малата и др. При этом потребность бактерий в углекислоте часто заметно снижается, хотя урожай клеток увеличивается. В зависимости от характера органического соединения, особенностей организма и условий, в которых он находится, пути ассимиляции органических субстратов, как и углекислоты, могут быть различными.
Нередко ассимиляция органических соединений связана с реакциями карбоксилирования, например происходит карбоксили-рование ацетил-КоА или пирувата. Может также происходить усвоение органических соединений в результате включения их в цикл трикарбоновых кислот и действия глиоксилатного шунта (рис. 136), которые функционируют у некоторых пурпурных бактерий.
В условиях интенсивного роста фототрофных бактерий большая часть первичных продуктов ассимиляции углекислоты и органических соединений используется на синтез белков и других важнейших компонентов клеток. Но при задержке роста культур в результате недостатка фосфора и особенно азота происходит образование в больших количествах запасных веществ. И пурпурные и зеленые бактерии могут накапливать в качестве запасных продуктов полисахариды типа гликогена. Пурпурные бактерии образуют, кроме того, поли-р-оксимасляную кислоту (С4Н602)n. Накопление того или другого запасного соединения зависит не только от особенностей организма, но и от источника углерода. Полисахариды преимущественно накапливаются пурпурными бактериями при культивировании их на минеральных средах, а также в присутствии пирувата, пропионата, малата или сукцината. При использовании бутирата или ацетата, особенно в отсутствие бикарбоната, происходит накопление почти исключительно поли-р-оксибутирата, так как синтез его начинается с конденсации двух молекул ацетил-КоА с образованием аце-тоацетил-КоА и далее в-оксибутирата.
Возможно также разложение фототрофными бактериями некоторых органических субстратов с выделением молекулярного водорода.
Во многих случаях этот процесс зависит от наличия света. Фотовыделение молекулярного водорода имеет также место при окислении нерастущими суспензиями клеток тиосуль<
Дата добавления: 2020-11-18; просмотров: 609;











