Молекулярная адсорбция из растворов
Явление адсорбции из растворов твердыми телами было открыто и изучено в 1785 г русским химиком и фармацевтом Т.Е.Ловицем (1757-1804).
Неэлектролиты и слабые электролиты адсорбируются на поверхности твердого тела в виде молекул. В результате адсорбции концентрация растворенного вещества в растворе уменьшается. Величину адсорбции определяют по разности концентраций исходного и равновесного растворов адсорбата.
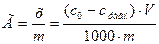
Где V – объем, из которого ведется адсорбция, мл
m – масса адсорбента, г
С0 – концентрация до адсорбции, моль/л
Сравн – равновесная концентрация, моль/л
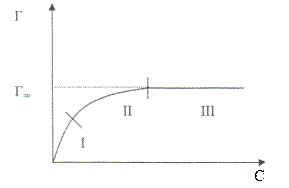
Рис. 10 Изотерма адсорбции
Изотерма адсорбции имеет вид параболы (Рис. 10). Ход кривой для средних концентраций (участок 2) описывает эмпирическое уравнение Фрейндлиха
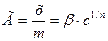 , где β и 1/n – константы.
, где β и 1/n – константы.
Физический смысл β становится ясным, если положить С = 1 моль/л, тогда β = Г, т.е. β – величина адсорбции при концентрации, равной единице.
1/n – адсорбционный показатель, принимающий значения в пределах 0,1 - 1.
β и 1/n зависят от природы адсорбента, адсорбата и температуры.·
При логарифмировании уравнение Фрейндлиха переходит в линейную форму
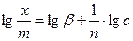
и в координатах lg x/m - lg C изотерма имеет вид прямой (Рис. 11). Линейная изотерма позволяет определить графически константы уравнения: отрезок на оси ординат - lg β, а tg α = 

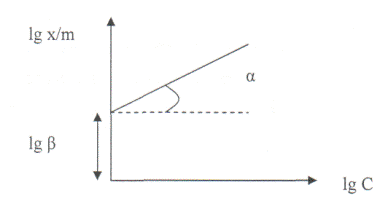
Рис. 11 График для определения констант уравнения адсорбции Фрейндлиха
Дата добавления: 2016-08-23; просмотров: 1881;











