Генетический контроль развития
Очевидно, что генетический контроль развития существует, ибо как тогда понять, почему из яйца крокодила развивается крокодил, а из яйца человека — человек. Каким образом гены определяют процесс развития? Это центральный и очень сложный вопрос, к которому ученые начинают подходить, но для всеобъемлющего и убедительного ответа на него данных явно недостаточно. Главным приемом ученых, изучающих генетику индивидуального развития, является использование мутаций. Выявив мутации, изменяющие онтогенез, исследователь проводит сравнение фенотипов мутантных особей с нормальными. Это помогает понять, как данный ген влияет на нормальное развитие. С помощью многочисленных сложных и остроумных методов стараются определить время и место действия гена.
Анализ генетического контроля затрудняется несколькими моментами. Прежде всего тем, что роль генов неодинакова. Часть генома состоит из генов, определяющих так называемые жизненно важные функции и отвечающих, например, за синтез тРНК или ДНК-полимеразы, без которых невозможно функционирование ни одной клетки. Эти гены названы «house keeping» или генами «домашнего хозяйства». Другая часть генов непосредственно участвует в детерминации, дифференцировке и морфогенезе, т.е. функция их, по-видимому, более специфическая, ключевая.
Для анализа генетического контроля необходимо, кроме того, знать место первичного действия данного гена, т.е. следует различать случаи относительной, или зависимой, плейотропии от прямой, или истинной, плейотропии. В случае относительной плейотропии, как, например, при серповидно-клеточной анемии, существует одно первичное место действия мутантного гена — гемоглобин в эритроцитах, а все остальные наблюдаемые при ней симптомы, такие, как нарушение умственной и физической деятельности, сердечная недостаточность, местные нарушения кровообращения, увеличение и фиброз селезенки и многие другие, возникают как следствие аномального гемоглобина. При прямой плейотропии все разнообразные дефекты, возникающие в различных тканях или органах, вызываются непосредственным действием одного и того же гена именно в этих разных местах.
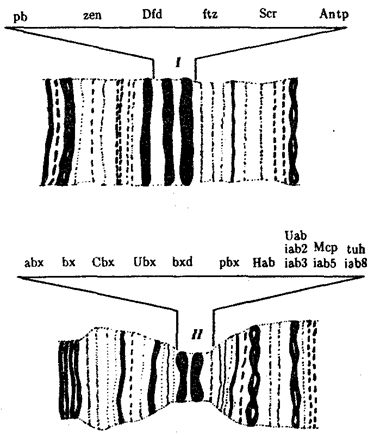
Рис. 8.14. Участки политенных хромосом дрозофилы
с указанием расположения комплексов ANT-C(I) и ВХ-С(II)
и генов, входящих в эти комплексы
Наконец, следует различать еще два способа действия мутаций на фенотип, вызывающих дизруптивные либо гомеозисные изменения. В первом случае, и это бывает чаще всего, мутации приводят к нарушению нормального развития, отсутствию или аномальному строению органов. В других случаях отклонение от нормы заключается в том, что под действием мутации типичный орган замещается гомологичным или совсем другим, но с нормальным строением. Это особый класс мутаций, описанный у насекомых и получивший название гомеозисных мутаций.
Примером гомеозисных мутаций являются мутации в ВХ-С и ANT-C-комплексах генов у дрозофилы (рис. 8.14). ВХ-С (Bithorax Complex) и ANT-C (Antennapedia Complex) — это два набора генов, представляющих собой два кластера тесно сцепленных между собой генов, находящихся в одном плече 3-й хромосомы (рис. 8.15). В группу ВХ-С входит не менее 10 генов, которые отвечают за индивидуальность сегментов тела, расположенных сзади от среднегрудного сегмента. Чем больше дистальных локусов ВХ-С подвергается делении, тем больше брюшных сегментов превращается в грудные. При делении всего комплекса ВХ-С все сегменты от заднегрудного до 8-го брюшного превращаются в среднегрудь. В группу ANT-C входит не менее шести генов. Усиление в результате мутации функции этой группы вызывает превращение антенны в ногу, как должно быть в грудных сегментах.
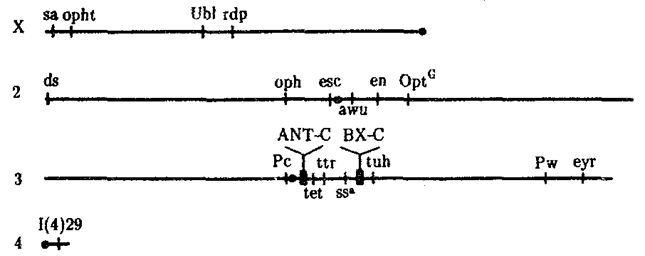
Рис. 8.15. Расположение гомеозисных комплексов мутантных генов
ANT-C и ВХ-С в геноме дрозофилы:
X, 2, 3, 4 —икс-, вторая, третья и четвертая хромосомы; черной точкой обозначены центромеры, латинскими буквами — некоторые гены
Обширные генетические исследования гомеозисных мутаций у дрозофилы показали, что эти комплексы генов отвечают за направление развития сегментов тела, т.е. являются как бы морфогенетическими переключателями. Этот вывод имеет большое теоретическое значение, так как позволяет предположить наличие таких генов-переключателей направления развития и у других видов организмов.
В предыдущих разделах были приведены примеры генетически запрограммированных процессов клеточного деления, клеточных миграций, клеточной гибели и клеточной дифференцировки, которые проявляются избирательно, т.е. в определенный период и в определенном месте. Можно привести еще множество примеров мутаций, которые показывают, как и когда действуют гены.
Существуют мутации, которые указывают на существование у многих видов животных так называемых генов с материнским эффектом. Особенность этих генов состоит в том, что материнский геном во время овогенеза продуцирует ферменты, необходимые для метаболизма раннего зародыша, а также передает информацию, касающуюся расположения и организации структур зародыша, т.е. оказывает влияние на морфогенез. Поэтому самка, гомозиготная по рецессивному мутантному аллелю и продуцирующая аномальные яйца, даже при скрещивании с нормальным самцом дает нежизнеспособное потомство. Сама же она развивалась вполне нормально, поскольку ее мать в этом случае могла быть только гетерозиготной и в ее яйцах были все факторы, необходимые для раннего развития. Интересно, что если в дефектные яйца рецессивной самки ввести цитоплазму от нормальных яиц, то зародыши будут спасены. Факторы, детерминируемые генами с материнским эффектом, обычно оказывают свое влияние на зародыш до периода гаструляции. Начиная с гаструляции все большую роль играет информация самого зародыша.
Известны и другие мутации, оказывающие влияние на раннее развитие, но не связанные с материнским эффектом. К ним относятся, например, мутации рибосомных генов. У шпорцевой лягушки (Xenopus laevis) мутанты были лишены части или всех рибосомных генов. Цитологически это проявлялось в полном или частичном отсутствии ядрышка. В гомозиготном состоянии мутантных аллелей зародыши становятся полностью нежизнеспособными на стадии выклева, так как у них не образуются новые рибосомы, а те, что были запасены в яйце, уже полностью использованы.
У мышей также известен целый ряд рецессивных мутаций сложного локуса Т 17-й хромосомы, затрагивающих раннее развитие. Локус Т представлен множеством (117) аллелей, обозначаемых знаком t с дополнительными индексами: t1, t2, t3 и т.д. Около 30% t-генов в гомозиготном состоянии вызывает гибель зародышей, часть аллелей являются полулетальными. Весь этот ряд рецессивных аллелей t распадается на восемь групп, которые могут быть комплементарны друг другу и в гетерозиготном состоянии не приводить к гибели зародыша.
Известны также и пять доминантных мутаций Т-локуса. Каждая из восьми групп обусловливает разного рода дефекты. Один из аллелей останавливает превращение морулы в бластоцисту, состоящую из трофобласта и эмбриобласта. Такие морулы гибнут. Другая мутация приводит к тому, что развившийся трофобласт не вступает в контакт со стенкой матки и зародыш тоже гибнет. Третьи мутантные зародыши не образуют внезародышевой эктодермы, у четвертых — гибнут клетки зародышевой эктодермы, у пятых — клетки зародышевой эктодермы не способны мигрировать в области первичной полоски и образовывать мезодерму, у шестых — уже образовавшиеся структуры нервной системы дегенерируют и т.д. Первичное нарушение, лежащее в основе всех этих эффектов, всего лишь одного локуса пока не выяснено. Однако очевидно, что локус Т играет первостепенную роль в морфогенезе эктодермы мышиного зародыша и организма в целом.
Известны мутации с более специфическим действием. У аксолотля мутация с (cardial lethal), наследуемая как простой аутосомно-рецессивный признак, вызывает нарушение развития сердца и его неспособность к сокращениям. Мутантные особи раздуты переполняющей их жидкостью, а пищеварительная система и жабры у них недоразвиты. Установлено, что у позвоночных сердце развивается в результате индукционного воздействия со стороны головного участка энтодермы. Опыты по пересадке сердечной мезодермы показали, что мутантные зародыши не могут обеспечить развитие сердца из подсаженной нормальной сердечной мезодермы. Это указывает на отсутствие индукционной активности головного участка энтодермы у мутанта с генотипом cc.
Неразрывную связь генов с морфогенезом отдельных органов и систем органов можно наблюдать также на примере мутации Tfm (Testicular feminization locus) у млекопитающих. У человека, мышей и крыс этот ген наследуется как сцепленный с полом. Самки, гетерозиготные по мутантному гену, т.е. ХTfmX, по существу, нормальны, но половина их генотипически мужских потомков ХTfmY имеют женский фенотип и стерильны. В основе этого дефекта лежит отсутствие специфического белка, служащего рецептором тестостерона. У особей ХTfmY рецептор не синтезируется. Самки ХTfmХTfm нормальны во всех отношениях и фертильны. Это свидетельствует о том, что нормальное половое развитие самки может проходить без продукта этого гена.
Органогенез — период, когда действие мутаций проявляется в большой мере. Развитие каждого органа и тем более системы органов контролируется совокупным координированным действием сотен генов. У человека известны свыше 120 форм наследственной глухоты, которые возникают в результате экспрессии мутантных генов, отвечающих за формирование слухового анализатора. У человека описано также около 250 наследственных поражений глаз, около 150 наследственных аномалий развития скелета, не менее 18 генов, отвечающих за нормальную дифференциацию пола. О значении генетического контроля онтогенеза говорят многочисленные болезни, связанные с геномными и хромосомными мутациями.
В целом генетический контроль онтогенеза очевиден, однако в процессе развития зародыш и его части обладают способностью к саморазвитию, регулируемому самой целостной развивающейся системой и не запрограммированному в генотипе зиготы.
Дата добавления: 2016-08-23; просмотров: 1959;











