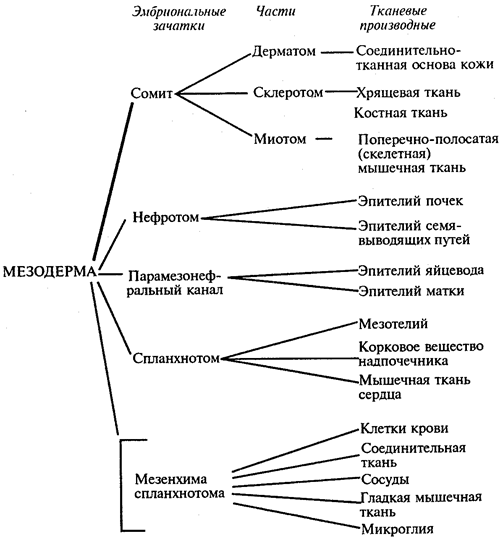
Схема 8.1. Дифференцировка мезодермы
Можно выделить целый ряд признаков, которые характеризуют степень дифференцированности клеток. Так, для недифференцированного состояния характерны относительно крупное ядро и высокое ядерно-цитоплазматическое отношение Vядра/Vцитоплазмы (V—объем), диспергированный хроматин и хорошо выраженное ядрышко, многочисленные рибосомы и интенсивный синтез РНК, высокая митотическая активность и неспецифический метаболизм. Все эти признаки изменяются в процессе дифференцировки, характеризуя приобретение клеткой специализации.
Процесс, в результате которого отдельные ткани в ходе дифференцировки приобретают характерный для них вид, называют гистогенезом. Дифференцировка клеток, гистогенез и органогенез совершаются в совокупности, причем в определенных участках зародыша и в определенное время. Это очень важно, потому что указывает на координированность и интегрированность эмбрионального развития.
В то же время удивительно, что, в сущности, с момента одноклеточной стадии (зиготы) развитие из нее организма определенного вида уже жестко предопределено. Всем известно, что из яйца птицы развивается птица, а из яйца лягушки —лягушка. Правда, фенотипы организмов всегда различаются и могут быть нарушены до степени гибели или возникновения порока развития, а нередко могут быть даже как бы искусственно сконструированы, например у химерных животных.
Требуется понять, каким образом клетки, обладающие чаще всего одинаковыми кариотипом и генотипом, дифференцируются и участвуют в гисто- и органогенезе в необходимых местах и в определенные сроки соответственно целостному «образу» данного вида организмов. Осторожность при выдвижении положения о том, что наследственный материал всех соматических клеток абсолютно идентичен, отражает объективную реальность и историческую неоднозначность в трактовке причин клеточной дифференцировки.
В. Вейсман выдвинул гипотезу о том, что только линия половых клеток несет в себе и передает потомкам всю информацию своего генома, а соматические клетки могут отличаться от зиготы и друг от друга количеством наследственного материала и поэтому дифференцироваться в разных направлениях. Ниже приведены факты, подтверждающие возможность изменения наследственного материала в соматических клетках, но их надо трактовать как исключения из правил.
Вейсман опирался на данные о том, что в ходе первых делений дробления яиц лошадиной аскариды происходит отбрасывание (элиминация) части хромосом в соматических клетках эмбриона. В дальнейшем было показано, что отбрасываемая ДНК содержит главным образом часто повторяющиеся последовательности, т.е. фактически не несущие информации.
Развитие представлений о механизмах цитодифференцировки изображено на схеме 8.2.

Позже были обнаружены и другие примеры изменения количества наследственного материала в соматических клетках как на геномном, так и на хромосомном и генном уровнях. Описаны случаи элиминации целых хромосом у циклопа, комара и у одного из представителей сумчатых. У последних из соматических клеток самки элиминируется Х-хромосома, а из клеток самца — Y-хромосома. В результате соматические клетки у них содержат только по одной Х-хромосоме, а в линии половых клеток сохраняются нормальные кариотипы:XX или XY.
В политенных хромосомах слюнных желез двукрылых ДНК может синтезироваться несинхронно, например при политенизации гетерохроматиновые участки реплицируются меньшее число раз, чем эухроматиновые. Сам процесс политенизации, напротив, приводит к значительному увеличению количества ДНК в дифференцированных клетках по сравнению с родоначальными клетками.
Такой механизм репликации ДНК, как амплификация, также приводит к многократному увеличению количества некоторых генов в одних клетках по сравнению с другими. В овогенезе многократно увеличивается число рибосомальных генов, могут амплифицироваться и некоторые другие гены. Имеются данные о том, что в некоторых клетках в процессе дифференцировки происходит перестройка генов, например иммуноглобулиновых генов в лимфоцитах.
Однако в настоящее время общепризнанной является точка зрения, ведущая начало от Т. Моргана, который, опираясь на хромосомную теорию наследственности, предположил, что дифференцировка клеток в процессе онтогенеза является результатом последовательных реципрокных (взаимных) влияний цитоплазмы и меняющихся продуктов активности ядерных генов. Таким образом, впервые прозвучала идея о дифферециальной экспрессии генов как основном механизме цитодифференцировки. В настоящее время собрано много доказательств того, что в большинстве случаев соматические клетки организмов несут полный диплоидный набор хромосом, а генетические потенции ядер соматических клеток могут сохраняться, т.е. гены не утрачивают потенциальной функциональной активности.
Сохранение полного хромосомного набора развивающегося организма обеспечивается прежде всего механизмом митоза (возможные случаи соматических мутаций, возникающих, как исключение, во внимание не принимаем). Проведенные цитогенетическим методом исследования кариотипов различных соматических клеток показали почти полную их идентичность. Цитофотометрическим способом установлено, что количество ДНК в них не уменьшается, а методом молекулярной гибридизации показано, что клетки разных тканей идентичны по нуклеотидным последовательностям. На этом основании цитогенетический метод применяют для диагностики хромосомных и геномных болезней человека (хотя ошибки методов достигают 5— 10%), а метод гибридизации ДНК —для идентификации личности и установления степени родства.
Помимо установленной количественной полноценности ДНК большинства соматических клеток большой интерес представляет вопрос о сохранении функциональных свойств содержащегося в них наследственного материала. Все ли гены сохраняют способность к реализации своей информации? О сохранении генетических потенций ядер можно судить по результатам опытов, проведенных над растениями и животными. Прошедшая длительный путь дифференцировки соматическая клетка моркови способна развиваться в полноценный организм (рис. 8.6). У животных отдельные соматические клетки после стадии бластулы, как правило, не способны развиваться в целый нормальный организм, но их ядра, будучи пересажены в цитоплазму овоцита или яйцеклетки, начинают вести себя соответственно той цитоплазме, в которой они оказались.
Опыты по пересадке ядер соматических клеток в яйцеклетку впервые были успешно осуществлены в 50-х гг. в США, а в 60—70-х гг. получили широкую известность опыты английского ученого Дж. Гердона. Используя африканскую шпорцевую лягушку Xenopus laevis, он в небольшом проценте случаев получил развитие взрослой лягушки из энуклеированной яйцеклетки, в которую пересаживал ядро из эпителиальной клетки кожи лягушки или кишечника головастика, т.е. из дифференцированной клетки (см. рис. 5.3). Энуклеацию яйцеклетки проводили большими дозами ультрафиолетового облучения, что приводило к функциональному удалению ее ядра. Для доказательства того, что в развитии зародыша участвует пересаженное ядро соматической клетки, применили генетическое маркирование. Яйцеклетку брали из линии лягушек с двумя ядрышками в ядре (соответственно двум ядрышковым организаторам в двух гомологичных хромосомах), а ядро клетки донора — из линии, имеющей в ядрах только одно ядрышко вследствие гетерозиготности по делении ядрышкового организатора. Все ядра в клетках особи, полученной в результате трансплантации ядра, имели только одно ядрышко.
Вместе с тем опыты Гердона обнаружили многие другие важнейшие закономерности. Во-первых, они еще раз подтвердили предположение Т. Моргана о решающем значении взаимодействия цитоплазмы и ядра в жизнедеятельности клеток и развитии организма. Во-вторых, в многочисленных экспериментах было показано, что чем старше стадия зародыша-донора, из клеток которого брали ядро для пересадки, тем в меньшем проценте случаев развитие оказывалось полностью завершенным, т.е. достигало стадий головастика, а затем лягушки.
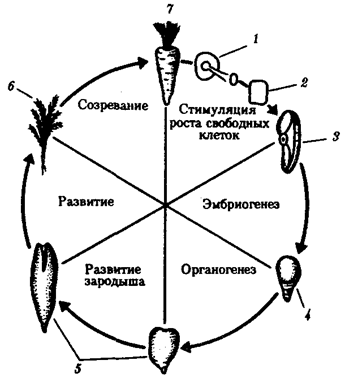
Рис. 8.6. Опыт, показывающий сохранение функциональных свойств наследственного материала в соматической дифференцированной клетке моркови:
1—срез корня в питательной среде, 2— профилирующие клетки в культуре, 3— клетка, изолированная из культуры, 4—ранний зародыш, 5—более поздний зародыш, 6—молодое растение, 7—взрослое растение
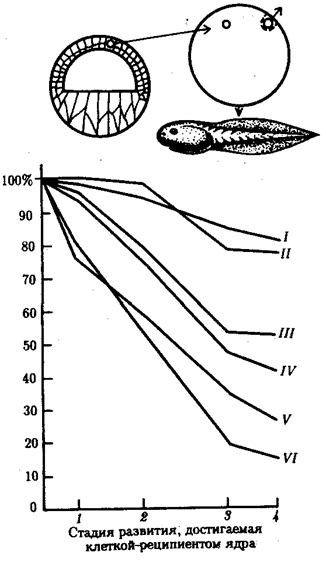
Рис. 8.7. Зависимость успеха пересадки ядер из дифференцированной клетки в яйцеклетку от возраста донора (I—VI) ядра: I—бластула, II—гаструла, III—нейрула, IV—появление мышечной реакции, V—начало сердечной деятельности и вылупления, VI—активное плавание; 1—ранняя гаструла, 2—нейрула, 3—плавающий головастик, 4—питающийся головастик;
вверху изображена схема опыта
В большинстве случаев развитие останавливалось на более ранних стадиях. Зависимость результатов пересадки от стадии зародыша-донора ядер представлена на рис. 8.7. Анализ зародышей, останавливающихся в развитии после пересадки ядра, показал множество хромосомных аномалий в их ядрах. Другой причиной остановки развития считают неспособность ядер дифференцированных клеток к восстановлению синхронной репликации ДНК.
Главный вывод, который вытекает из этого опыта, заключается в том, что наследственный материал соматических клеток способен сохраняться полноценным не только в количественном, но и в функциональном отношении, цитодифференцировка не является следствием недостаточности наследственного материала.
Самым последним достижением в этой области является получение овечки Долли. Ученые не исключают возможности воспроизведения подобным же образом, т.е. путем пересадки ядер, генетических двойников человека. Следует однако отдавать себе отчет, что клонирование человека кроме научно-технологического имеет также этический и психологический аспекты.
Гипотеза дифференциальной экспрессии генов в признак принимается в настоящее время в качестве основного механизма цитодифференцировки.
Общие принципы регуляции экспресии генов изложены в гл. 3.6.6. В данной главе делается попытка выяснить механизмы регуляции избирательной проявляемости генов в признак применительно к развивающемуся многоклеточному организму, у которого судьбы отдельных групп клеток неотрывны от пространственно-временных аспектов индивидуального развития. Уровни регуляции дифференциальной экспрессии генов соответствуют этапам реализации информации в направлении ген → полипептид → признак и включают не только внутриклеточные процессы, но тканевые и организменные.
Экспрессия гена в признак — это сложный этапный процесс, который можно изучать разными методами: электронной и световой микроскопией, биохимически и другими. На схеме 8.3 приведены основные этапы экспрессии генов и методы, с помощью которых их можно изучать.
Схема 8.3
| Этапы экспресии генов | Методы их изучения |
| Активность генов Транскрипция, первичный РНК-транскрипт (ядерные РНК) мРНК цитоплазмы Трансляция (белки — продукты генной активности) Морфологическая дифференцировка Строение и жизнеспособность зародыша | Визуальное наблюдение строения соответствующих участков хромосомы (электронная и световая микроскопия) Метод двумерного гельэлектрофореза Биохимический метод Биохимический метод Цитологический метод, цитохимический метод Гибридологический и сравнительно эмбриологический методы |
Визуальное наблюдение в электронный микроскоп, как наиболее прямой подход к изучению уровня транскрипции, т.е. генной активности, проведено в отношении только отдельных генов — рибосомных, генов хромосом типа ламповых щеток и некоторых других (см. рис. 3.66). На элекгронограммах отчетливо видно, что одни гены транскрибируются активнее других. Хорошо различимы и неактивные гены.
Особое место занимает изучение политенных хромосом. Политенные хромосомы — это гигантские хромосомы, обнаруживаемые в интерфазных клетках некоторых тканей у мух и других двукрылых. Такие хромосомы есть у них в клетках слюнных желез, мальпигиевых сосудов и средней кишки. Они содержат сотни нитей ДНК, которые редуплицировались, но не подверглись расхождению. При окраске в них выявляются четко выраженные поперечные полосы или диски (см. рис. 3.56). Многие отдельные полосы соответствуют местоположению отдельных генов. Ограниченное число определенных полос в некоторых дифференцированных клетках образует вздутия, или пуфы, выступающие за пределы хромосомы. Эти вздутые участки находятся там, где гены наиболее активны в отношении транскрипции. Было показано, что клетки разного типа содержат разные пуфы (см. рис. 3.65). Изменения в клетках, происходящие в ходе развития, коррелируют с изменениями в характере пуфов и синтезом определенного белка. Других примеров визуального наблюдения генной активности пока нет.
Все остальные этапы экспрессии генов являются результатом сложных видоизменений продуктов первичной генной активности. Под сложными изменениями подразумевают посттранскрипционные преобразования РНК, трансляцию и посттрансляционные процессы.
Имеются данные по изучению количества и качества РНК в ядре и цитоплазме клеток организмов, находящихся на разных стадиях эмбрионального развития, а также в клетках различных типов у взрослых особей. Обнаружено, что сложность и число различных видов ядерной РНК в 5—10 раз выше, чем мРНК. Ядерные РНК, которые представляют собой первичные продукты транскрипции, всегда длиннее, чем мРНК. Кроме того, ядерная РНК, изученная на морском еже, по количеству и качественному разнообразию идентична на различных стадиях развития особи, а мРНК цитоплазмы отличается.в клетках разных тканей. Это наблюдение приводит к мысли о том, что посттранскрипционные механизмы влияют на дифференциальную экспрессию генов.
Примеры посттранскрипционной регуляции экспрессии генов на уровне процессинга известны. Мембранно-связанная форма иммуноглобулина IgM у мышей отличается от растворимой формы дополнительной аминокислотной последовательностью, позволяющей мембранно-связанной форме «заякориваться» в клеточной мембране. Оба белка кодируются одним локусом, но процессинг первичного транскрипта протекает по-разному. Пептидный гормон кальцитонин у крыс представлен двумя разными белками, детерминированными одним геном. У них одинаковые первые 78 аминокислот (при общей длине 128 аминокислот), а различия обусловлены процессингом, т.е. опять наблюдается дифференциальная экспрессия одного и того же гена в различных тканях. Есть и другие примеры. Вероятно, альтернативный процессинг первичных транскриптов играет очень важную роль в дифференцировке, однако остается неясным его механизм.
Большая часть мРНК цитоплазмы одинакова по качественному составу в клетках, относящихся к различным стадиям онтогенеза. мРНК необходимы для обеспечения жизнедеятельности клеток и детерминируются генами «домашнего хозяйства», представленными в геноме в виде нескольких нуклеотидных последовательностей со средней частотой повторяемости. Продуктами их активности являются белки, необходимые для сборки клеточных мембран, различных субклеточных структур и т.д. Количество этих мРНК составляет примерно 9/10 от всех мРНК цитоплазмы. Остальные мРНК являются необходимыми для определенных стадий развития, а также различных типов клеток.
При изучении разнообразия мРНК в почках, печени и головном мозге мышей, в яйцеводах и печени кур было обнаружено около 12000 различных мРНК. Лишь 10—15% были специфичны для какой-либо одной ткани. Они считываются с уникальных нуклеотидных последовательностей тех структурных генов, действие которых специфично в данном месте и в данный момент и которые называются генами «роскоши». Количество их соответствует примерно 1000—2000 генов, ответственных за дифференцировку клеток.
Не все гены, имеющиеся в клетке, вообще реализуются до этапа образования мРНК цитоплазмы, но и эти образовавшиеся мРНК не все и не во всяких условиях реализуются в полипептиды и тем более в сложные признаки. Известно, что некоторые мРНК блокируются на уровне трансляции, будучи в составе рибонуклеопротеиновых частиц — информосом, вследствие чего происходит задержка трансляции. Это имеет место в овогенезе, в клетках хрусталика глаза.
В ряде случаев окончательная дифференцировка связана с «достройкой» молекул ферментов или гормонов или четвертичной структуры белка. Это уже посттрансляционные события. Например, фермент тирозиназа появляется у зародышей амфибий еще в раннем эмбриогенезе, но переходит в активную форму лишь после их вылупления.
Другим примером является дифференцировка клеток, при которой они приобретают способность реагировать на определенные вещества не сразу после синтеза соответствующего рецептора, а только в определенный момент. Показано, что мышечные волокна в своей мембране имеют рецепторы к медиаторному веществу ацетилхолину. Интересно, однако, что эти холинорецепторы обнаруживали внутри цитоплазмы клеток-миобластов до образования ими мышечных волокон, а чувствительность к ацетилхолину возникала только с момента встраивания рецепторов в плазматическую мембрану во время образования мышечных трубочек и мышечных волокон. Этот пример показывает, что экспрессия генов и тканевая дифференцировка могут регулироваться после трансляции в процессе межклеточных взаимодействий.
Таким образом, дифференцировка клеток не сводится только к синтезу специфических белков, поэтому применительно к многоклеточному организму эта проблема неотрывна от пространственно-временных аспектов и, следовательно, от еще более высоких уровней ее регуляции, нежели уровни регуляций биосинтеза белкана клеточном уровне. Дифференцировка всегда затрагивает группу клеток и соответствует задачам обеспечения целостности многоклеточного организма.
Дата добавления: 2016-08-23; просмотров: 2858;











