Схема полимолекулярной адсорбции
| молекула газа | ++ | свободный активный центр | =« | единичный адсорбционный комплекс |
| молекула газа | ++ | единичный адсорбционный комплекс | =« | двойной адсорбционный комплекс |
Можно показать, что в этом случае константа равновесия адсорбции выражается уравнением 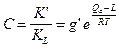 , где
, где 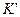 - константа равновесия образования единичного адсорбционного комплекса, KL - константа равновесия образования всех последующих комплексов,
- константа равновесия образования единичного адсорбционного комплекса, KL - константа равновесия образования всех последующих комплексов,  - чистая теплота адсорбции.
- чистая теплота адсорбции.
Уравнение изотермы адсорбции в теории БЭТ имеет вид:
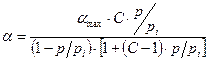 , где
, где 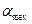 - емкость монослоя,
- емкость монослоя, 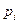 - давление насыщенного пара при данной температуре. Уравнение () описывает всю изотерму полимолекулярной адсорбции (рис. 3.19)
- давление насыщенного пара при данной температуре. Уравнение () описывает всю изотерму полимолекулярной адсорбции (рис. 3.19)
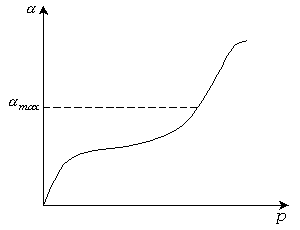
Рис. 3.19. Изотерма полимолекулярной адсорбции.
При 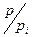 <<1 и
<<1 и 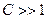 ,
, 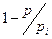 »1 и уравнение () переходит в уравнение Ленгмюра:
»1 и уравнение () переходит в уравнение Ленгмюра: 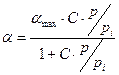
По теории БЭТ легко найти удельную поверхность адсорбента 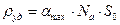 , где
, где 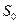 - площадь, занимаемая одной молекулой адсорбата.
- площадь, занимаемая одной молекулой адсорбата.
Для решения уравнения БЭТ его приводят к линейной форме:
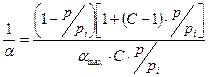 | :
| : 
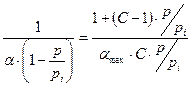 | ´
| ´ 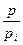
и почленно делят числитель на знаменатель
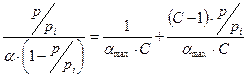
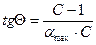
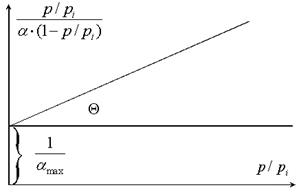
Рис. 3.20.
Так графически находят значения констант 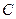 и amax.
и amax.
IV. Адсорбция на границе раствора с газом
Адсорбция на границе раствора с газом имеет существенные отличия от адсорбции газа на поверхности твердого тела. Адсорбтивом в этом случае является растворенное вещество. Так как система трехкомпонентная, то возникает конкуренция растворителя и растворенного вещества. Адсорбционное равновесие устанавливается замедленно, так как диффузия в жидкости протекает медленнее, чем в газе. Поверхность жидкости энергетически однородна, на ней отсутствуют активные центры, поэтому адсорбция физическая и всегда нелокализована. Молекулярно-кинетические представления для адсорбции из раствора на границе с газом неприменимы, применяется термодинамический подход.
Для многокомпонентной системы одним из путей понижения свободной поверхностной энергии FS, является перераспределение молекул в растворе, приводящее к изменению состава поверхностного слоя. Рассмотрим фундаментальное уравнение Гиббса:
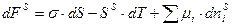
Изменение состава поверхностного слоя влияет на величину поверхностного натяжения, энтропии поверхностного слоя и свободной поверхностной энергии. Условием самопроизвольной адсорбции является уменьшение свободной поверхностной энергии 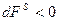 . При
. При 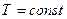
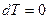 ,
,  изменение состава поверхностного слоя влияет, прежде всего, на поверхностное натяжение
изменение состава поверхностного слоя влияет, прежде всего, на поверхностное натяжение 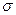 , которое связано с величиной адсорбции.
, которое связано с величиной адсорбции.
4.1 Поведение растворенных веществ на границе раствора с газом
По способности адсорбироваться на поверхности и по характеру взаимосвязи адсорбции и изменения поверхностного натяжения вещества делятся на три группы: положительно поверхностно-активные вещества (ПАВ), отрицательно поверхностно-активные или инактивные вещества (ПИАВ) и поверхностно-неактивные вещества (ПНВ). ПАВ - это вещества, состоящие из органического радикала и полярной группы, менее полярные, чем растворитель (вода) 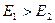 . Молекулы растворителя сильнее взаимодействуют между собой, чем с молекулами растворенного вещества. Взаимодействие
. Молекулы растворителя сильнее взаимодействуют между собой, чем с молекулами растворенного вещества. Взаимодействие  >
>  , поэтому молекулам растворителя энергетически выгодно находиться в собственном окружении, а молекулам растворенного вещества энергетически выгодно находиться не в объеме, т.е. в окружении молекул растворителя, а на поверхности. Молекулы растворителя как бы выталкивают молекулы ПАВ на поверхность. Особенно сильно это проявляется в водных растворах, вследствие высокой концентрации водородных связей в воде. Поэтому ПАВ обладают малой растворимостью. Они концентрируются на поверхности, адсорбируются, для них величина адсорбции положительна
, поэтому молекулам растворителя энергетически выгодно находиться в собственном окружении, а молекулам растворенного вещества энергетически выгодно находиться не в объеме, т.е. в окружении молекул растворителя, а на поверхности. Молекулы растворителя как бы выталкивают молекулы ПАВ на поверхность. Особенно сильно это проявляется в водных растворах, вследствие высокой концентрации водородных связей в воде. Поэтому ПАВ обладают малой растворимостью. Они концентрируются на поверхности, адсорбируются, для них величина адсорбции положительна 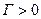 . Поскольку взаимодействие молекул ПАВ с молекулами растворителя слабее, чем молекул растворителя между собой, то поверхностное натяжение раствора уменьшается по сравнению с чистым растворителем
. Поскольку взаимодействие молекул ПАВ с молекулами растворителя слабее, чем молекул растворителя между собой, то поверхностное натяжение раствора уменьшается по сравнению с чистым растворителем 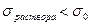 . Изотерма поверхностного натяжения подобна перевернутой изотерме адсорбции (рис.4.1).
. Изотерма поверхностного натяжения подобна перевернутой изотерме адсорбции (рис.4.1).
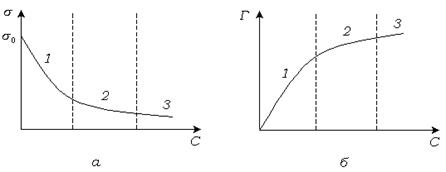
Рис. 4.1. Изотермы поверхностного натяжения ( 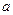 ) и адсорбции (б).
) и адсорбции (б).
Изотерма поверхностного натяжения выпукла к оси абсцисс, т. к. поверхностный слой обладает насыщаемостью.
На изотермах имеется три участка. На первом участке 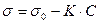 идет активная адсорбция. На втором участке идет дальнейшее заполнение адсорбционного слоя
идет активная адсорбция. На втором участке идет дальнейшее заполнение адсорбционного слоя  . На третьем участке поверхностный слой заполнен полностью
. На третьем участке поверхностный слой заполнен полностью 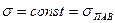 .
.
4.2 Поверхностная активность.
Для кривой 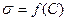 как убывающей функции характерна отрицательная первая производная
как убывающей функции характерна отрицательная первая производная 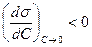 , называемая поверхностной активностью.
, называемая поверхностной активностью.
Поверхностная активность не является абсолютным свойством веществ, а зависит от природы поверхности раздела фаз. Спирты поверхностно – активны по отношению к воде, но инактивны по отношению к границе неполярного углеводорода с воздухом.
Молекулы поверхностно – активных веществ (ПАВ) состоят из полярной и неполярной частей, т.е. они дифильны (амфифильны). Углеводородная часть молекулы ответственна за растворимость в масле, тогда как полярная 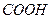 или
или 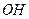 группа имеет большое сродство к воде и увлекает за собой неполярную углеводородную часть в водный раствор. Если эти молекулы находятся на поверхности раздела воды с воздухом или маслом, то гидрофильные группы находятся в водной фазе, а липофильные углеводородные цепи – в воздушной или масляной фазе (рис. 4.2).
группа имеет большое сродство к воде и увлекает за собой неполярную углеводородную часть в водный раствор. Если эти молекулы находятся на поверхности раздела воды с воздухом или маслом, то гидрофильные группы находятся в водной фазе, а липофильные углеводородные цепи – в воздушной или масляной фазе (рис. 4.2).

Рис. 4.2. Расположение молекул ПАВ на границе воды с воздухом ( 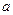 ) и с маслом (б)
) и с маслом (б)
Такое расположение молекул энергетически более выгодно, чем полное растворение в каждой фазе. Сильная адсорбция таких веществ на поверхности или в межфазном слое в форме ориентированного мономолекулярного слоя (монослоя) связана с высокой поверхностной активностью этих веществ. Поверхностная активность является динамическим явлением, так как конечное состояние поверхности или межфазного слоя определяется равновесием между адсорбцией и полным смешением вследствии теплового движения молекул.
Способность молекул ПАВ упаковываться в межфазном слое приводит к его растяжению, тогда как силы поверхностного натяжения приводят к сжатию поверхностного слоя. Если растягивающее (или поверхностное) давление адсорбированного слоя ПАВ обозначить через 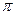 , то поверхностное или межфазное натяжение будет меньше исходного
, то поверхностное или межфазное натяжение будет меньше исходного 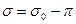 . Если межфазное натяжение между двумя жидкостями уменьшается до достаточно низкого значения при добавлении ПАВ, то то легко протекает эмульгирование, так как это требует относительно малого увеличения свободной поверхностной энергии системы. Если
. Если межфазное натяжение между двумя жидкостями уменьшается до достаточно низкого значения при добавлении ПАВ, то то легко протекает эмульгирование, так как это требует относительно малого увеличения свободной поверхностной энергии системы. Если 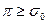 , то жидкости либо смешиваются, либо происходит самопроизвольное эмульгирование.
, то жидкости либо смешиваются, либо происходит самопроизвольное эмульгирование.
4.3 Поверхностно – инактивные вещества
Поверхностно – инактивные вещества являются антиподами ПАВ. Молекулы ПИАВ более полярны, чем молекулы растворителя 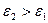 . Для них силы притяжения молекул растворенного вещества и растворителя больше, чем силы притяжения молекул растворителя между собой,т.е. взаимодействие типа 1-1 < 1-2, и молекулам растворенного вещества выгоднее находиться в окружении молекул растворителя. Вследствии этого молекулы растворенного вещества стремятся мигрировать с поверхности в объем, для системы это термодинамически выгодно. Поэтому ПИАВ характеризуются отрицательной адсорбцией, недостатком вещества на поверхности, для них
. Для них силы притяжения молекул растворенного вещества и растворителя больше, чем силы притяжения молекул растворителя между собой,т.е. взаимодействие типа 1-1 < 1-2, и молекулам растворенного вещества выгоднее находиться в окружении молекул растворителя. Вследствии этого молекулы растворенного вещества стремятся мигрировать с поверхности в объем, для системы это термодинамически выгодно. Поэтому ПИАВ характеризуются отрицательной адсорбцией, недостатком вещества на поверхности, для них 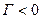 . ПИАВ обладают высокой растворимостью и значением поверхностного натяжения большим, чем у растворителя,
. ПИАВ обладают высокой растворимостью и значением поверхностного натяжения большим, чем у растворителя, 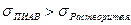 .
.
Вследствии высокой растворимости, сродства к растворителю, поверхностно-инактивное вещество хорошо взаимодействует с растворителем и находится в объеме, а не на поверхности. Поверхностное натяжение раствора становится больше, чем чистого растворителя 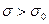 , так как взаимодействие между молекулами ПИАВ и растворителя больше, чем между молекулами растворителя. Поэтому
, так как взаимодействие между молекулами ПИАВ и растворителя больше, чем между молекулами растворителя. Поэтому 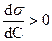 .
.
Вид изотермы поверхностного натяжения и адсорбции растворов, содержащих ПИАВ, показан на рис. 4.3.
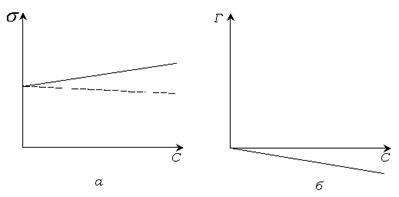
Рис. 3.3 Изотермы поверхностного натяжения (а) и адсорбции (б) растворов ПИАВ.
Наклон изотерм не большой, так как повышение свободной поверхностной энергии 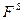 невыгодно. Вследствие теплового движения молекулы ПИАВ находятся и в поверхностном слое. Некоторое увеличение поверхностного натяжения, а значит и
невыгодно. Вследствие теплового движения молекулы ПИАВ находятся и в поверхностном слое. Некоторое увеличение поверхностного натяжения, а значит и 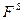 перекрывается ростом энтропии системы за счет распределения вещества. Если бы в поверхностном слое не было бы молекул адсорбата, энтропия системы была бы меньше.
перекрывается ростом энтропии системы за счет распределения вещества. Если бы в поверхностном слое не было бы молекул адсорбата, энтропия системы была бы меньше.
К ПИАВ относятся неорганические электролиты, образующие гидратированные ионы, кислоты, щелочи, соли, а также хорошо ионизирующиеся органические кислоты, у которых органическая часть отсутствует или мала, например, муравьиная, аминоуксусная кислоты. Так как ионы электролита гидратированы, они не могут подходить к поверхности ближе, чем на толщину гидратной оболочки. Выход иона непосредственно в поверхностный слой термодинамически невыгоден вследствие затраты энергии на гидратацию иона.
| |
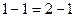 . Поэтому вещество равномерно распределяется в объеме и на поверхности и адсорбция равна нулю,
. Поэтому вещество равномерно распределяется в объеме и на поверхности и адсорбция равна нулю,  . Значения поверхностного натяжения раствора и чистого растворителя равны,
. Значения поверхностного натяжения раствора и чистого растворителя равны, 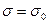 . К поверхностно-неактивным веществам относятся сахара. Изотермы поверхностного натяжения ПАВ, ПИАВ и поверхностно-неактивных веществ показаны на рис. 4.4.
. К поверхностно-неактивным веществам относятся сахара. Изотермы поверхностного натяжения ПАВ, ПИАВ и поверхностно-неактивных веществ показаны на рис. 4.4.
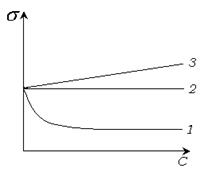
Рис. 4.4 Изотермы поверхностного натяжения.
1 - ПАВ. 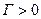 ;
; 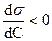 .
.
2 - неактивные вещества 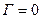 ;
; 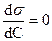 .
.
3 - ПИВ. 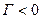 ;
; 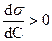 .
.
После качественного рассмотрения связи адсорбции с поверхностным натяжением перейдем к количественному.
4.4 Вывод адсорбционного уравнения Гиббса
Запишем фундаментальное уравнение Гиббса для поверхностного слоя.
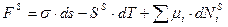 (1)
(1)
Введем полную (внутреннюю) энергию поверхностного слоя.
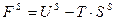 ;
;  (2)
(2)
Приравниваем правые части уравнений (1) и (2)
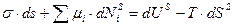
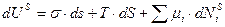 (3)
(3)
Это уравнение однородно и первой степени относительно экстенсивных величин, стоящих под знаком дифференциала.
По теореме Эйлера его можно интегрировать. После интегрирования это уравнение принимает вид:
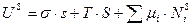 (4)
(4)
Рассмотрим любые возможные изменения системы, т.е. возьмем полный дифференциал от выражения (4).
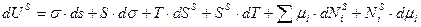 (5)
(5)
Уравнение (3) и (5) совместимы при условии:
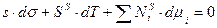
Это общий вид адсорбционного уравнения Гиббса. Введем некоторые ограничения. При 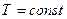 уравнение Гиббса принимает вид:
уравнение Гиббса принимает вид:
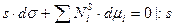 ,
,
Все экстенсивные параметры поверхности ( 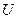 ,
, 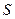 ,
, 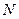 ) зависят от площади поверхности
) зависят от площади поверхности 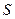 и, поэтому их удобно относить к единице площади.
и, поэтому их удобно относить к единице площади.

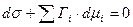 , т. к.
, т. к.
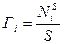 – мера избыточного содержания компонента в поверхностном слое, мера адсорбции, т. е. величина гиббсовой адсорбции.
– мера избыточного содержания компонента в поверхностном слое, мера адсорбции, т. е. величина гиббсовой адсорбции.
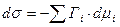
Для бинарной системы:
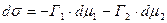 ;
;
где индекс 1 относится к растворителю, 2 – к растворенному веществу. Изменение 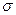 связано с адсорбцией и с изменением концентрации растворителя и растворенного вещества. Это уравнение содержит два неизвестных,
связано с адсорбцией и с изменением концентрации растворителя и растворенного вещества. Это уравнение содержит два неизвестных, 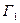 ,
, 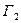 и поэтому однозначное его решение отсутствует. Один из путей его решения следующий. Величины адсорбции зависят от положения разделяющей поверхности. В зависимости от выбора положения разделяющей поверхности адсорбция первого компонента оказывается положительной, отрицательной или равной нулю. Гиббс показал, что разделяющую поверхность можно провести так чтобы
и поэтому однозначное его решение отсутствует. Один из путей его решения следующий. Величины адсорбции зависят от положения разделяющей поверхности. В зависимости от выбора положения разделяющей поверхности адсорбция первого компонента оказывается положительной, отрицательной или равной нулю. Гиббс показал, что разделяющую поверхность можно провести так чтобы  и
и 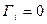 . При таком выборе разделяющей поверхности можно считать, что адсорбция растворителя отсутствует
. При таком выборе разделяющей поверхности можно считать, что адсорбция растворителя отсутствует 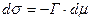 .
.
Перейдем к концентрации.
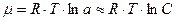 , где
, где 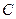 – равновесная концентрация в объеме.
– равновесная концентрация в объеме.
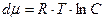 ;
; 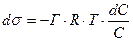 ;
; 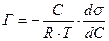 ;
;
Это одно из наиболее важных уравнений коллоидной химии. Оно связывает величину адсорбции с поверхностным натяжением.
Уравнение Гиббса подтверждено экспериментально методом среза тонких слоев и их анализа.
Из этого уравнения видно, что для ПАВ величина адсорбции растет с увеличением концентрации и понижением температуры. Величину 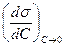 называют поверхностной активностью и обозначают символом
называют поверхностной активностью и обозначают символом  в честь Гиббса. Единицей измерения поверхностной активности служит 1 Гиббс.
в честь Гиббса. Единицей измерения поверхностной активности служит 1 Гиббс.
Проведем анализ уравнения Гиббса. Если 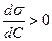 , то
, то 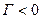 , что характерно для ПИАВ, проявляющих отрицательную адсорбцию.
, что характерно для ПИАВ, проявляющих отрицательную адсорбцию.
Если 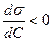 , то
, то 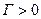 , что характерно для ПАВ, проявляющих положительную адсорбцию. Если
, что характерно для ПАВ, проявляющих положительную адсорбцию. Если 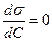 , то
, то 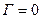 , что характерно для неактивных веществ.
, что характерно для неактивных веществ.
Используя уравнение Гиббса, можно найти величину адсорбции 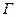 для любого значения
для любого значения 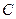 , из тангенса угла наклона касательной к экспериментальной кривой
, из тангенса угла наклона касательной к экспериментальной кривой 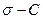 . Таким путем можно перейти от изотермы поверхностного натяжения к изотерме адсорбции (рис.4.5)
. Таким путем можно перейти от изотермы поверхностного натяжения к изотерме адсорбции (рис.4.5)
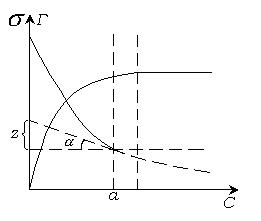
Рис. 4.5. Переход от изотермы поверхностного натяжения к изотерме адсорбции.
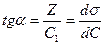
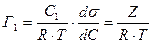
Решив уравнение Гиббса для ряда точек, строят изотерму адсорбции.
4.5 Строение адсорбционного слоя ПАВ на границе раствора с газом
Мы рассмотрели основные закономерности адсорбции ПАВ на границе раствора с газом с термодинамической точки зрения. Рассмотрим теперь ориентацию молекул ПАВ на поверхности и строение адсорбционного слоя.
Пленки ПАВ, образующиеся на поверхности воды, могут находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Агрегатное состояние пленки определяется силами межмолекулярного взаимодействия и площадью, занимаемой молекулой на поверхности. Выталкивание молекул ПАВ на поверхность и их упаковка в адсорбционном слое приводят к растяжению адсорбционного слоя и к существованию поверхностного давления 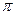 . Силы поверхностного натяжения, наоборот, сжимают поверхностный слой.
. Силы поверхностного натяжения, наоборот, сжимают поверхностный слой.
Если между молекулами действуют слабые силы, а поверхность велика, то молекулы на поверхности вследствие теплового движения находятся в состоянии двумерного газа. Газообразные пленки образуют дифильные органические вещества с определенной длиной углеводородного радикала, например, жирные кислоты с числом атомов углерода от 11 до 14.
В зависимости от длины углеводородного радикала ПАВ и площади, занимаемой молекулой, монослои ПАВ обладают морфизмом, т.е. способны к фазовым переходам. Сжатие монослоя обеспечивается плавучим барьером, на который действует определенная сила. При отсутствии действия силы на подвижный барьер монослой находится в газообразном состоянии (рис.4.6, 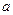 ).
).

Рис.4.6. Агрегатные состояния поверхностных пленок ПАВ.
Под действием сравнительно небольшой силы на плавучий барьер монослой переходит в жидкое состояние. Молекулы ПАВ на поверхности группируются и образуют островки (рис.5, б). При дальнейшем увеличении действующей на барьер силы, т. е. уменьшение площади, занимаемой молекулой ПАВ, монослой переходит в жидко-кристаллическое состояние (рис.5, в).
4.6 Уравнение состояния двумерного газа.
В двумерном газе действует поверхностное давление, которое является растягивающим, в противоположность поверхностному натяжению, сжимающему поверхность. Это давление равно 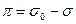 . При малом содержании ПАВ, т.е. в состоянии двумерного газа
. При малом содержании ПАВ, т.е. в состоянии двумерного газа 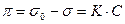 . После дифференцирования получим:
. После дифференцирования получим:
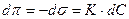 (1)
(1)
Подставим уравнение (1) в уравнение Гиббса:
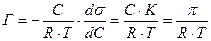
Площадь, занимаемую одним молем ПАВ, обозначим через 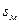 . Тогда
. Тогда
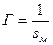 ;
; 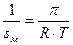 ;
; 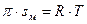 .
.
Это уравнение состояния двумерного газа аналогично уравнению газа 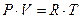 .
.
Для реального двумерного газа справедливо уравнение Фрумкина, аналогичное уравнению Ван-дер Ваальса:
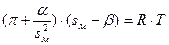
где 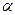 - константа взаимодействия молекул ПАВ в поверхностном слое,
- константа взаимодействия молекул ПАВ в поверхностном слое, 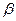 - эффективная площадь сечения молекулы.
- эффективная площадь сечения молекулы.
В конденсированных пленках молекулы ПАВ находятся в виде отдельных островков (жидкие пленки) или частокола Ленгмюра (твердые пленки).
4.7 Диаграммы состояния поверхностных пленок
Фазовое состояние поверхностных пленок описывается диаграммой состояния или изотермой сжатия, которая может быть построена в координатах 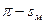 .
.
Поверхностное давление измеряют непосредственно с помощью весов Ленгмюра. Этот метод основан на прямом измерении горизонтальной силы, которая действует на поплавок, отделяющий пленку от поверхности чистого растворителя. Современные весы позволяют определять поверхностные давления с точностью до сотых долей дины на см. В общем случае при уменьшении площади реализуются газообразное, жидкое и твердое состояние монослоя. Каждое состояние монослоя характеризуется определенной ориентацией молекул, зависящей от 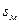 , адгезионных и когезионных свойств систем. В диапазоне давления и площади, занимаемой 1 молем ПАВ, отвечающем всем трем агрегатным состояниям пленки, диаграмма состояния имеет вид, показанный на рисунке 4.7.
, адгезионных и когезионных свойств систем. В диапазоне давления и площади, занимаемой 1 молем ПАВ, отвечающем всем трем агрегатным состояниям пленки, диаграмма состояния имеет вид, показанный на рисунке 4.7.
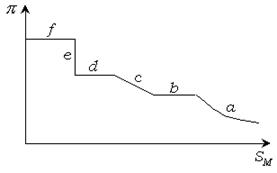
Рис. 4.7. Диаграмма состояния поверхностных пленок.
Участок 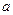 соответствует двумерному газу и аналогичен кривой сжатия газа. На участке
соответствует двумерному газу и аналогичен кривой сжатия газа. На участке 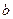 происходит конденсация. В этом состоянии пленка называется растянутой жидкой пленкой и способна к сжатию, которому соответствует участок
происходит конденсация. В этом состоянии пленка называется растянутой жидкой пленкой и способна к сжатию, которому соответствует участок 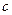 . На участке
. На участке 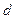 происходит фазовый переход, участку
происходит фазовый переход, участку 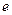 соответствует конденсированная (твердая) пленка. Участку
соответствует конденсированная (твердая) пленка. Участку 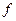 соответствует разрушение мономолекулярной пленки, т. е. образование капли для жидкой пленки или многослойных образований для твердой пленки. Поверхностные пленки реальных ПАВ описываются диаграммами состояния, отвечающими определенному участку общей диаграммы состояния. Это зависит от длины углеводородного радикала молекулы ПАВ. Так, лауриновая кислота
соответствует разрушение мономолекулярной пленки, т. е. образование капли для жидкой пленки или многослойных образований для твердой пленки. Поверхностные пленки реальных ПАВ описываются диаграммами состояния, отвечающими определенному участку общей диаграммы состояния. Это зависит от длины углеводородного радикала молекулы ПАВ. Так, лауриновая кислота 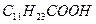 благодаря сравнительно короткому радикалу образует только газообразные пленки (кривые 1, 2, 3, рис.4.8).
благодаря сравнительно короткому радикалу образует только газообразные пленки (кривые 1, 2, 3, рис.4.8).
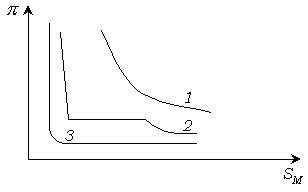
Рис.7
Рис. 4.8. Диаграммы состояния поверхностных пленок лауриновой (1), миристиновой (2) и пальмитиновой (3) кислот.
Миристиновая кислота 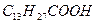 образует как газообразные, так и конденсированные пленки. Пальмитиновая кислота
образует как газообразные, так и конденсированные пленки. Пальмитиновая кислота  при обычной температуре образует только конденсированные пленки вследствие большой длины углеводородного радикала.
при обычной температуре образует только конденсированные пленки вследствие большой длины углеводородного радикала.
4.8 Химические реакции в поверхностных пленках.
Поверхностные пленки обладают электрическим зарядом, который влияет на химические реакции, идущие по ионному механизму. К таким реакциям относится большинство жизненно важных биохимических каталитических реакций (ферментативный синтез, протеолиз, лактонизация кислот, омыление жиров).
Введение в поверхностную пленку веществ, вызывающее изменение величины или знака ее электрического потенциала, может изменить скорость химической реакции в пленках на несколько порядков. Заряд поверхности изменяет свою величину, и знак при переходе от пленок жирных кислот к пленкам, которые образуют их соли (рис.4.9)
Пленки жирных кислот, спиртов, сложных эфиров со стороны газовой фазы обладают положительным зарядом вследствие избытка электронной плотности на атомах кислорода (рис. 4.9)
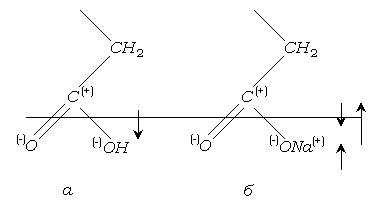
Рис. 4.9.
Соли жирных кислот образуют отрицательно заряженные пленки, так как диполь карбоксильной группы перекрывается большим по величине и противоположным по направлению диполем ионной пары.
Для кислот значения электронного потенциала поверхности резко уменьшается, и затем изменяют свой знак с увеличением 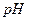 раствора (рис.4.10 кривая 1)
раствора (рис.4.10 кривая 1)

Рис. 4.10
Для спиртов значения 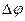 уменьшаются в щелочной области в связи с образованием алкоголятов (кривая 2), а для сложных эфиров значение потенциала поверхности не зависит от
уменьшаются в щелочной области в связи с образованием алкоголятов (кривая 2), а для сложных эфиров значение потенциала поверхности не зависит от 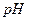 (прямая 3).
(прямая 3).
4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
Метод переноса пленок с поверхности воды на твердые пластины разработаны Ленгмюром и Блоджетт в 1935 году.
В связи с этим методом, который в настоящее время получил важнейшие технологические применения, интересно сделать небольшой исторический экскурс.
Впервые толщину монослоя оливкового масла на поверхности воды измерил Б. Франклин в 1774г. Она оказалась равной 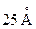 .
.
В 90-х г.г. прошлого века Поккельс обнаружила возможность регулирования площади пленки с помощью подвижного барьера. Она установила, что поверхностное натяжение пленки изменяется лишь до тех пор, пока площадь, занимаемая молекулой, не уменьшится до  на молекулу.
на молекулу.
В 1917 г. последовали классические работы Ленгмюра по исследованию мономолекулярных пленок и созданию пленочных весов.
В 1935 г. Блоджетт предложила простой, изящный, ювелирно тонкий метод перенесения мономолекулярных пленок на твердые подложки.
В Англии эти работы были продолжены с участием М. Тетчер1.
Суть метода состоит в том, что вначале на поверхности воды образуется мономолекулярная пленка дифильного вещества с определенной ориентацией гидрофильных и гидрофобных групп (частокол Ленгмюра). Затем этот монослой переносится на твердую пластину путем ее медленного перемещения через поверхность жидкости. Перенос может, осуществляется двояко: опусканием пластины в воду или поднятием пластины из воды. В зависимости от гидрофильности пластины и способа переноса получается определенная ориентация молекул ПАВ в монослое. Так, если стеклянную пластинку поднимать из воды через монослой стеарата бария, образуется пленка, гидрофобная сторона которой обращена наружу (рис.4.11)
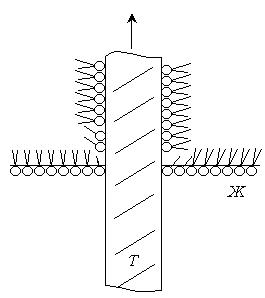
Рис. 4.11. Перенос монослоя стеарата бария на стеклянную пластинку по методу Блоджетт.
Если затем перемещать эту пленку,с нанесенным монослоем, в обратном направлении, т.е. опускать в воду, то на пластине осаждается второй слой стеарата бария "спиной к спине" с обратной ориентацией молекул, т.е. наружная поверхность пленки будет гидрофильной. Этот способ переноса называется вертикальным.
Таким способом можно нанести сотни монослоев. Характер заключительной стадии определяет конечные свойства пленки, ее гидрофильность или гидрофобность.
При опускании гидрофобной пластинки в воду также образуется монослой, соответствующей ориентации (рис.4.12).

Рис. 4.12
Необходимо лишь строго синхронизировать скорость перемещения подвижного барьера и поднятия (опускания) пластины для сохранения сплошности мономолекулярной пленки.
При поднятии пластинки с монослоем из воды образуется второй слой. Пленки, состоящие из таких мультислоев, определенным образом классифицируются.
 и
и 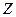 пленки состоят из несимметричных монослоев.
пленки состоят из несимметричных монослоев.  - пленка образуется на гидрофобной подложке путем ее опускания ванну. В такой пленке гидрофобные части молекул обращены к подложке (рис. 4.13
- пленка образуется на гидрофобной подложке путем ее опускания ванну. В такой пленке гидрофобные части молекул обращены к подложке (рис. 4.13 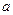 ).
). 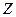 - пленка образуется на гидрофильной подложке путем ее поднятия из ванны. К подложке, соответственно, обращены полярные группы молекул (рис. 4.13в).
- пленка образуется на гидрофильной подложке путем ее поднятия из ванны. К подложке, соответственно, обращены полярные группы молекул (рис. 4.13в). 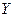 - пленка состоит из симметричных монослоев (рис. 4.13б) и формируется путем последовательного движения подложки вверх-вниз.
- пленка состоит из симметричных монослоев (рис. 4.13б) и формируется путем последовательного движения подложки вверх-вниз.
Рис. 12
Рис. 4.13. Пленки Ленгмюра - Блоджетт различной ориентации.
Пленки типа  и
и  не всегда получаются. При попытке получить
не всегда получаются. При попытке получить  - пленку с жирными кислотами получаются
- пленку с жирными кислотами получаются  - слои, т. к. молекулы опрокидываются.
- слои, т. к. молекулы опрокидываются.
Получение пленок на твердой подложке путем последовательного переноса монослоя с поверхности жидкости можно отнести к молекулярному творчеству. Этим методом можно конструировать слои на молекулярном уровне, с точным контролем толщины пленки и двумерного упорядочного расположения молекул. По словам известного физико-химика Доннана "ориентацию молекул и ионов на поверхности раздела мы можем воспринимать как первые признаки организованной структуры жизни".
Схема установки для перенесения монослоев на твердую подложку Ленгмюра- Блоджетт изображена на рис.4.14
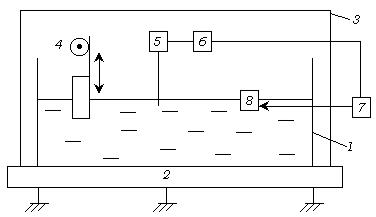
Рис. 4.14. Схема установки для получения пленок Ленгмюра-Блоджетта
1- ванна; 2 – станина на амортизаторе; 3 – прозрачный колпак; 4- механизм подъема и опускания подложки (9); 5 – весы Вильгельми
На качество пленки влияет чистота воды и установки, 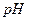 раствора, температура, подготовка подложки, скорость нанесения монослоя, отсутствие механических вибраций. Обычно подложка поднимается или опускается со скоростью несколько миллиметров в минуту.
раствора, температура, подготовка подложки, скорость нанесения монослоя, отсутствие механических вибраций. Обычно подложка поднимается или опускается со скоростью несколько миллиметров в минуту.
Аналогично мультимолекулярным пленкам построены липидные мембраны. На этом сходстве основан термин "биоподражательная электроника".
Эти пленки находят широкое применение в новейших отраслях техники. Они применяются для создания оптоэлектронных устройств в физике, химических сенсоров и биосенсоров.
На смену микроэлектронике, благодаря таким пленкам, идет молекулярная электроника. Объемные устройства в электронике заменяются поверхностными. Элемент в электронных устройствах имеет размер 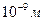 . Это означает, что на печатной плате размером с человеческий ноготь размещается
. Это означает, что на печатной плате размером с человеческий ноготь размещается  элементов, из них
элементов, из них 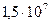 транзисторов, т. е. достигается очень высокая плотность монтажа.
транзисторов, т. е. достигается очень высокая плотность монтажа.
В настоящее время контролируемые изменения монослоев с целью получения мультимолекулярных пленок на устройствах, снабженных компьютерами, стали предметом технологий в ряде стран. Это послужило основой для создания компьютеров нового поколения, в миллион раз более эффективных и в триллион раз более производительных чем существующие.
Такая технология называется субмикронной или нанотехнологией (от греческого нано-карликовая). Уже в настоящее время это привело к микроминиатюризации вычислительной и видеотехники.
На пленках Ленгмюра-Блоджетт (ЛБ) могут быть иммобилизованы энзимы, что открывает возможности применения пленок ЛБ в качестве биосенсоров. Липидный монослой имеет поверхностный заряд на гидрофильной группе. Заряд энзима (белка) контролируется изменением 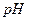 раствора. При соответствующих условиях белок адсорбируется на липидном слое с образованием монослоев, иммобилизировавших белок. Такие пленки применяются в качестве биосенсоров.
раствора. При соответствующих условиях белок адсорбируется на липидном слое с образованием монослоев, иммобилизировавших белок. Такие пленки применяются в качестве биосенсоров.
4.10 Двухсторонние пленки
Двухсторонние пленки состоят из двух поверхностных слоев и внутреннего однородного слоя, представляющего собой маточную жидкость, из которой образовалась пленка. Концентрация ПАВ в поверхностном слое значительно выше, чем в маточном растворе. Поэтому свойства наружных и внутреннего слоев различны, в частности, различен показатель преломления.
При наблюдении двухсторонних пленок отмечается взаимное гашение падающего и отраженного света. Когда это гашение является полным, то пленка становится черной. Образование черных пленок происходит вследствие вытеснения жидкости из среднего слоя пленки. При максимальном сближении двух поверхностных слоев образуется предельно утонченные пленки, толщина которых составляет 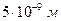 . Эти пленки являются черными.
. Эти пленки являются черными.
Процесс образования черных пленок происходит скачкообразно. Вначале на пленке образуются отдельные черные пятна, которые затем сливаются.
4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
На изотерме поверхностного натяжения имеются три участка (рис. 4.15).
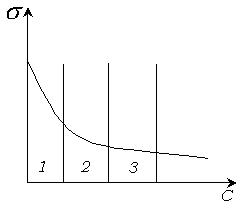
Рис. 4.15
Первый и третий участок - прямолинейные, а второй характеризуется логарифмической зависимостью σ от С. Для этого участка польский ученый Шишковский в 1908 г. предложил эмпирическое уравнение:
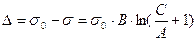 ,
,
где 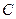 - концентрация ПАВ,
- концентрация ПАВ,
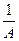 - удельная капиллярная постоянная, характерная для каждого ПАВ,
- удельная капиллярная постоянная, характерная для каждого ПАВ,
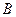 - константа, мало зависящая от природы ПАВ.
- константа, мало зависящая от природы ПАВ.
При малых 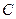 :
:
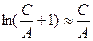
по формуле разложения в ряд и уравнение принимает вид:
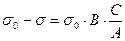
т. е. описывает первый прямолинейный участок. После дифференцирования:
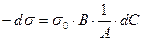 ;
; 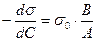 ,
,
т. е. можно определить поверхностную активность.
Для определения констант уравнения Шишковского рассмотрим второй участок изотермы поверхностного натяжения. При больших 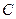 можно пренебречь единицей, и тогда
можно пренебречь единицей, и тогда
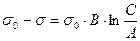
Это уравнение прямой линии в координатах 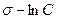 (рис. 4.16).
(рис. 4.16).
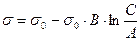
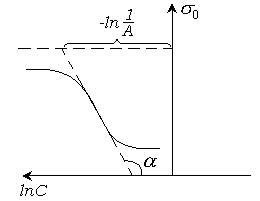
Рис. 4.16. Определение констант уравнения Шишковского.
Из этого рисунка видно, что
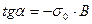
При 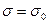 :
:
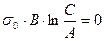 ;
; 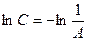 ,
,
т. е. отрезок, отсекаемый прямой линией на линии 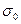 равен
равен 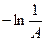 .
.
4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
Выше говорилось о том, что уравнение Шишковского является эмпирическим. После разработки представлений о мономолекулярной адсорбции Ленгмюр теоретически получил уравнение, носящее его имя:
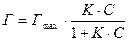 (1)
(1)
Оказалось возможным получить уравнение на основе уравнений Ленгмюра и Гиббса. Запишем уравнение Гиббса.
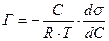 (2)
(2)
Приравниваем уравнения (1) и (2) –
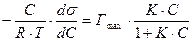
Разделим переменные и проинтегрируем:
 ;
; 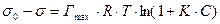
Сравнивая с уравнением Шишковского, видим, что
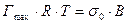 , а
, а 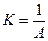
Таким образом, уравнения, описывающ
Дата добавления: 2020-11-18; просмотров: 756;











