Спектры валентных электронов ряда атомов химических элементов
Углерод имеет шесть электронов. Самым активным валентным электроном является его электрон, имеющий наименьшую энергию ионизации 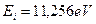 и следующий ряд энергий возбуждения, соответствующих стационарным энергетическим уровням [7]: 7,48; 7,68; 7,95; 9,68; 9,71; 9;83; 10,38; 10,39; 10,40; 10,42; 10,43; 10,71; 10,72; 10,73; 10,88; 10,89; 10,98; 10,99; 13,12 eV. Первые три подчеркнутых значения настолько близки, что у нас есть основания полагать, что они принадлежат триплету, поэтому найдем их среднее значение
и следующий ряд энергий возбуждения, соответствующих стационарным энергетическим уровням [7]: 7,48; 7,68; 7,95; 9,68; 9,71; 9;83; 10,38; 10,39; 10,40; 10,42; 10,43; 10,71; 10,72; 10,73; 10,88; 10,89; 10,98; 10,99; 13,12 eV. Первые три подчеркнутых значения настолько близки, что у нас есть основания полагать, что они принадлежат триплету, поэтому найдем их среднее значение 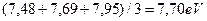 . Тогда разность энергий будет равна
. Тогда разность энергий будет равна 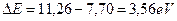 , а фиктивная энергия связи с ядром атома, соответствующая первому энергетическому уровню, будет такой
, а фиктивная энергия связи с ядром атома, соответствующая первому энергетическому уровню, будет такой 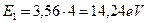 . Подставляя
. Подставляя 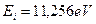 и
и 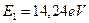 в формулы (149) и (151), найдем (табл. 24).
в формулы (149) и (151), найдем (табл. 24).
Таблица 24. Спектр 1-го электрона атома углерода
| Значения | n | |||||
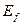 (эксп.) (эксп.)
| eV | 7,68 | 9,67 | 10,37 | 10,69 | 10,86 |
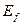 (теор.) (теор.)
| eV | 7,70 | 9,68 | 10,38 | 10,71 | 10,88 |
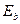 (теор.) (теор.)
| eV | 3,58 | 1,58 | 0,89 | 0,57 | 0,39 |
Подготовим читателя к неожиданностям, которые встретятся нам при анализе структуры ядер и атомов химических элементов. Первая неожиданность заключается в том, что энергии связи всех электронов с ядрами атомов, находящихся в свободном состоянии, примерно одинаковые. С первого взгляда это противоречит эксперименту, так как он дает разные значения энергий связи разных электронов с ядрами атомов. Однако надо учитывать условия экспериментов, которые дают такие различия.
Процесс фиксирования спектральных линий происходит в условиях перехода атомов в свободное состояние. При этом почти все электроны атома имеют, примерно, одинаковую возможность отделиться от него. Но как только один электрон покинул атом, так сразу же освободившийся протон в ядре начинает распространять свое действие на другие электроны, увеличивая притяжение их к ядру, а значит и энергию связи [1], [3].
Обычно электроны из атома удаляются последовательно по одному. Так как каждый из них взаимодействует с одним протоном ядра, то освобождающиеся протоны начинают взаимодействовать с электронами, которые остаются в атоме. В результате энергия связи электронов, оставшихся в атоме увеличивается. Когда электрон остается один в атоме, то он взаимодействует со всеми протонами ядра и энергия его связи с ядром увеличивается пропорционально квадрату количества протонов в ядре.
Следовательно, все электроны атомов на одноименных энергетических уровнях имеют примерно такие же энергии связи 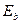 с ядром, как и электрон атома водорода (табл. 9, 17, 19). Дальше, при анализе структур атомов мы убедимся в справедливости этого предположения. А сейчас рассчитаем спектры двух электронов атома кислорода.
с ядром, как и электрон атома водорода (табл. 9, 17, 19). Дальше, при анализе структур атомов мы убедимся в справедливости этого предположения. А сейчас рассчитаем спектры двух электронов атома кислорода.
Наименьшая энергия ионизации электрона атома кислорода равна 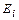 = 13,618 eV, а энергия связи этого электрона с ядром атома, соответствующая первому энергетическому уровню, -
= 13,618 eV, а энергия связи этого электрона с ядром атома, соответствующая первому энергетическому уровню, - 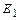 =13,752 eV. Назовем этот электрон первым. Расчет энергетических показателей этого электрона по формулам (149) и (151) даёт следующие результаты (табл. 25).
=13,752 eV. Назовем этот электрон первым. Расчет энергетических показателей этого электрона по формулам (149) и (151) даёт следующие результаты (табл. 25).
Таблица 25. Спектр первого электрона атома кислорода
| Значения | n | |||||
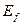 (эксп.) (эксп.)
| eV | 10,18 | 12,09 | 12,76 | 13,07 | 13,24 |
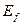 (теор.) (теор.)
| eV | 10,16 | 12,09 | 12,76 | 13,07 | 13,24 |
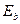 (теор.) (теор.)
| eV | 3,44 | 1,53 | 0,86 | 0,55 | 0,38 |
Энергия ионизации второго электрона атома кислорода равна 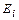 =35,116 eV, а энергия его связи с ядром атома, соответствующая первому энергетическому уровню,
=35,116 eV, а энергия его связи с ядром атома, соответствующая первому энергетическому уровню, 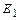 =83,98 eV. Мы обращаем внимание читателей на большие расхождения экспериментальных данных по второму потенциалу ионизации, помещенных в справочниках [6] и [7]. Мы с большим доверием отнеслись к новым данным, помещённым в справочнике [6]. Учитывая все это, спектр второго электрона атома кислорода оказался таким (табл. 26).
=83,98 eV. Мы обращаем внимание читателей на большие расхождения экспериментальных данных по второму потенциалу ионизации, помещенных в справочниках [6] и [7]. Мы с большим доверием отнеслись к новым данным, помещённым в справочнике [6]. Учитывая все это, спектр второго электрона атома кислорода оказался таким (табл. 26).
Таблица 26. Спектр второго электрона атома кислорода
| Значения | n | |||||
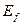 (эксп.) (эксп.)
| eV | 14,12 | 25,83 | 29,81 | 31,73 | 32,88 |
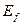 (теор.) (теор.)
| eV | 14,12 | 25,79 | 29,87 | 31,76 | 32,78 |
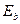 (теор.) (теор.)
| eV | 21,00 | 9,33 | 5,25 | 3,36 | 2,33 |
Как известно, хлор является 17-м элементом таблицы Менделеева. Потенциал ионизации его 1-го электрона 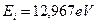 , а энергия связи его с ядром атома, соответствующая первому энергетическому уровню,
, а энергия связи его с ядром атома, соответствующая первому энергетическому уровню, 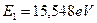 . Экспериментальные и теоретические значения энергий
. Экспериментальные и теоретические значения энергий 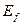 поглощаемых и излучаемых фотонов этим электроном, соответствующие разным энергетическим уровням, и энергии связи
поглощаемых и излучаемых фотонов этим электроном, соответствующие разным энергетическим уровням, и энергии связи 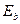 этого электрона с ядром атома хлора приведены в таблице 27.
этого электрона с ядром атома хлора приведены в таблице 27.
Таблица 27. Спектр 1-го электрона атома хлора
| Значения | n | |||||
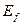 (эксп.) (эксп.)
| eV | 9,08 | 11,25 | 12,02 | 12,34 | 12,53 |
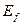 (теор.) (теор.)
| eV | 9,08 | 11,24 | 11,99 | 12,34 | 12,54 |
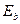 (теор.) (теор.)
| eV | 3,89 | 1,72 | 0,97 | 0,62 | 0,43 |
Медь - 29 элемент таблицы. Потенциал ионизации его 1-го электрона равен 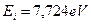 , а энергия связи, соответствующая первому фиктивному энергетическому уровню,
, а энергия связи, соответствующая первому фиктивному энергетическому уровню, 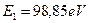 . Остальные энергетические показатели этого электрона приведены в таблице 28.
. Остальные энергетические показатели этого электрона приведены в таблице 28.
Таблица 28. Спектр 1-го электрона атома меди
| Значения | n | |||||
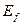 эксп.) эксп.)
| eV | 3,77 | 4,97 | 5,72 | 6,19 | 6,55 |
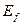 (теор.) (теор.)
| eV | 3,77 | 4,98 | 5,71 | 6,18 | 6,50 |
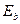 (теор.) (теор.)
| eV | 3,96 | 2,75 | 2,02 | 1,54 | 1,22 |
Первый электрон атома натрия (Na) также имеет наименьшие энергии связи с ядром, поэтому он является главным валентным электроном этого атома (табл. 30). Энергия ионизации первого электрона атома натрия равна 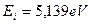 , а энергия связи с ядром, соответствующая первому энергетическому уровню, -
, а энергия связи с ядром, соответствующая первому энергетическому уровню, - 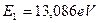 . Подставляя эти результаты в формулы (149) и (151), найдем (табл. 29).
. Подставляя эти результаты в формулы (149) и (151), найдем (табл. 29).
Таблица 29. Спектр 1-го электрона атома натрия
| Значения | n | |||||
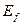 (эксп.) (эксп.)
| eV | - | 3,68 | 4,31 | 4,62 | 4,78 |
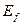 (теор.) (теор.)
| eV | - | 3,68 | 4,32 | 4,62 | 4,77 |
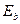 (теор.) (теор.)
| eV | 3,27 | 1,45 | 0,82 | 0,52 | 0,36 |
В таблице 29 приведены теоретические 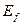 (теор.) и экспериментальные
(теор.) и экспериментальные 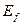 (эксп.) значения энергий фотонов, излучаемых или поглощаемых этим электроном, и энергии его связи
(эксп.) значения энергий фотонов, излучаемых или поглощаемых этим электроном, и энергии его связи 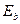 (теор.) с ядром атома, рассчитанные по формулам (149) и (151). Обращаем внимание на то, что второй энергетический уровень у этого электрона, также как и первый, фиктивный [1], [3].
(теор.) с ядром атома, рассчитанные по формулам (149) и (151). Обращаем внимание на то, что второй энергетический уровень у этого электрона, также как и первый, фиктивный [1], [3].
Современные теории образования молекул устанавливают лишь значение энергии, необходимой, как в них трактуется, для переноса одного электрона и оценивают ее равной 1,2 - 1,3 eV. Это энергия связи электрона с ядром неизвестного энергетического уровня.
Как видно из нашего анализа, каждый электрон имеет серию энергий связи. Новая теория позволяет рассчитать эти энергии для любого энергетического уровня электрона и определять номер этого уровня, а значит и расстояние между ядром атома и валентным электроном.
Завершая изложение теории формирования спектров атомов и ионов, отметим важные моменты для тех, кто будет продолжать эти исследования. Прежде всего, это лишь начало. Оно базируется на результатах экспериментов. Если результаты эксперимента отличаются от реального спектра того или иного электрона, то резко усложняется процедура поиска энергии 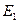 . Поскольку величина этой энергии базируется на значении энергии возбуждения, которая стоит первой в ряду всех энергий возбуждения, соответствующих стационарным энергетическим уровням, то точное определение первой энергии возбуждения играет решающую роль. Но существующие справочники по спектроскопии не отвечают этому требованию. Возьмем, например, энергии возбуждения, соответствующие стационарным энергетическим уровням второго электрона атома углерода.
. Поскольку величина этой энергии базируется на значении энергии возбуждения, которая стоит первой в ряду всех энергий возбуждения, соответствующих стационарным энергетическим уровням, то точное определение первой энергии возбуждения играет решающую роль. Но существующие справочники по спектроскопии не отвечают этому требованию. Возьмем, например, энергии возбуждения, соответствующие стационарным энергетическим уровням второго электрона атома углерода.
В справочнике [6] Стриганова содержится следующий ряд этих энергий: 5,33; 9,29; 11,96; 13,71; 13,72; 14,45; 18,04; 19,49; 20,84; 21,49; 22,13; 22,47; 22,57; 22,82; 23,38; 26,58 eV. В справочнике [7] Зайделя этот ряд имеет такие значения: 9,30; 11,96; 13,72; 14,46; 16,32; 17,62; 18,04; 18,06; 18,66; 19,49; 20,14; 20,84; 20,91; 20,95;22,13; 22,54; 22,56; 22,90; 23,11; 24,27; 24,37; 24,59; 24,64; 25,98; 27,41; 27,47; 27,48 eV.
Подчеркнутые значения энергий совпадают в обоих справочниках, а не подчеркнутые - не совпадают. Как видно, не так легко найти энергию, которая соответствует первому уровню возбуждения. Задача эта, видимо, должна решаться путем увеличения количества справочников, привлекаемых для анализа, и разработке специальной компьютерной программы, которая обеспечивала бы решение поставленной задачи. Если встретятся такие ряды энергий, которые не подчиняются закону (149), то это будет означать, что ячейка такого электрона занимает нестандартное положение в атоме. Не исключено, что в ряде случаев придется повторить эксперименты для более точного определения первого потенциала возбуждения.
Заключение
Выявлена математическая модель (149) для расчета спектров многоэлектронных атомов. Из неё следует отсутствие орбитального движения электрона в атоме. Это требует пересмотра сложившихся представлений о структуре атомов с орбитальным движением электронов. Энергии связи всех электронов с протонами ядер изменяются по закону (151).
МОДЕЛИ ЯДЕР АТОМОВ
Дата добавления: 2020-11-18; просмотров: 445;











