Другий закон (друге начало) термодинаміки: в ізольованій системі неможливий перехід теплоти від менш нагрітого тіла до більш нагрітого.
Це формулювання 2-го закону термодинаміки належить німецькому фізику Клаузіусу, який в 1865 р. ввів у науку фундаментальне поняття ентропії. Ентропія 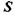 - це така функція стану, що характеризує напрямок самодовіль-ного процесу в ізольованій системі. Ентропія ізольованої системи зростає з наближенням до рівноважного стану. У рівновазі ентропія досягає свого максимального значення.
- це така функція стану, що характеризує напрямок самодовіль-ного процесу в ізольованій системі. Ентропія ізольованої системи зростає з наближенням до рівноважного стану. У рівновазі ентропія досягає свого максимального значення.
Важлива роль, яка відводиться в термодинаміці ентропії, пов'язана принаймні з двома причинами:
1) зміна ентропії 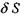 характеризує теплоту
характеризує теплоту 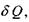 яку одержала або віддала система при взаємодії з оточенням:
яку одержала або віддала система при взаємодії з оточенням: 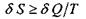 (знак "=" відповідає зворотним процесам, тоді як знак ">" - незворотним, реальним процесам в природі);
(знак "=" відповідає зворотним процесам, тоді як знак ">" - незворотним, реальним процесам в природі);
2) ентропія характеризує ступінь впорядкованості (або невпорядкованості) системи. Згідно з принципом Больцмана ентропія пов'язана з термодинамічною ймовірністю 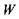 стану системи за допомогою такого фундаментального співвідношення:
стану системи за допомогою такого фундаментального співвідношення:
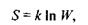 (5.2)
(5.2)
де 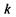 - стала Больцмана. Не входячи в теоретичні тонкощі, можна стверджувати, що термодинамічна ймовірність
- стала Больцмана. Не входячи в теоретичні тонкощі, можна стверджувати, що термодинамічна ймовірність 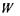 дорівнює числу мікростанів, за допомогою яких реалізується даний емпіричний стан системи при заданій енергії, об'ємі та кількості частинок.
дорівнює числу мікростанів, за допомогою яких реалізується даний емпіричний стан системи при заданій енергії, об'ємі та кількості частинок.
Термодинамічні потенціали. Термодинамічний стан будь-якої системи повністю визначається її термодинамічними потенціалами.Для кожного повного набору незалежних термодинамічних параметрів існує певний термодинамічний потенціал, за допомогою якого можуть бути обчислені будь-які макроскопічні характеристики системи. Наведемо визначення і основні властивості чотирьох термодинамічних потенціалів - внутрішньої енергії, ентропії, вільної енергії Гіббса і вільної енергії Гельмгольця.
Внутрішня енергія 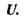 Перші два закони (начала) термодинаміки дають спільно такий вираз для зміни внутрішньої енергії відкритої однокомпонентної системи:
Перші два закони (начала) термодинаміки дають спільно такий вираз для зміни внутрішньої енергії відкритої однокомпонентної системи:
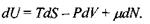 (5.3)
(5.3)
З цього співвідношення випливає, що внутрішня енергія є природним термодинамічним потенціалом при обранні в якості набору незалежних змінних ентропії 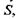 об'єму
об'єму 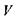 і кількості часток
і кількості часток 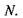 Диференціювання внутрішньої енергії дає такі параметри, як температура
Диференціювання внутрішньої енергії дає такі параметри, як температура 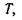 тиск
тиск 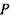 і хімічний потенціал
і хімічний потенціал 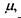 що є спряженими в термодинамічному сенсі обраному набору незалежних змінних:
що є спряженими в термодинамічному сенсі обраному набору незалежних змінних:
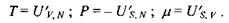
Очевидно, що зміна внутрішньої енергії при адіабатичному процесі 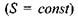 визначається роботою діючих на систему зовнішніх сил, тоді як в умовах постійності об'єму
визначається роботою діючих на систему зовнішніх сил, тоді як в умовах постійності об'єму 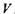 ця зміна визначається теплотою, що передається системі.
ця зміна визначається теплотою, що передається системі.
Ентропія (тепловміст) 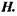 Ентропія пов'язана з внутрішньою енергією таким співвідношенням:
Ентропія пов'язана з внутрішньою енергією таким співвідношенням:
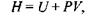
а її повний диференціал
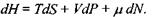 (5.4)
(5.4)
З цього виразу стає зрозуміло, що ентропія, як термодинамічний потенціал, має бути використана для набору незалежних змінних 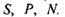 Для ізобаричного процесу зміна ентропії визначається теплотою, що поглинає (віддає) система. Диференціювання ентропії дає параметри:
Для ізобаричного процесу зміна ентропії визначається теплотою, що поглинає (віддає) система. Диференціювання ентропії дає параметри:
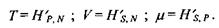
Вільна енергія Гіббса 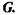 Вільна енергія Гіббса пов'язана такими співвідношеннями з внутрішньою енергією і ентропією:
Вільна енергія Гіббса пов'язана такими співвідношеннями з внутрішньою енергією і ентропією:
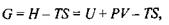
а її повний диференціал
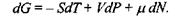 (5.5)
(5.5)
Видно, що вільній енергії Гіббса відповідає набір незалежних змінних 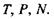 Спряжені в термодинамічному значенні параметри виходять як такі похідні від вільної енергії Гіббса:
Спряжені в термодинамічному значенні параметри виходять як такі похідні від вільної енергії Гіббса:
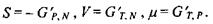
Останнє співвідношення показує, що хімічний потенціал 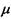 є вільна енергія Гіббса в розрахунку на один моль при сталих температурі та тиску. У зв'язку з проведеним у попередньому шостому розділі розглядом мембранних електричних потенціалів клітин зауважимо, що в присутності електричного поля та із врахуванням розчиненої речовини хімічний потенціал (в цьому випадку його називають електрохімічним потенціалом) має такий вигляд:
є вільна енергія Гіббса в розрахунку на один моль при сталих температурі та тиску. У зв'язку з проведеним у попередньому шостому розділі розглядом мембранних електричних потенціалів клітин зауважимо, що в присутності електричного поля та із врахуванням розчиненої речовини хімічний потенціал (в цьому випадку його називають електрохімічним потенціалом) має такий вигляд:
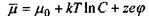 (в розрахунку на одну молекулу);
(в розрахунку на одну молекулу);
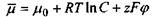 (в розрахунку на один моль),
(в розрахунку на один моль),
де 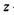 - валентність;
- валентність; 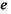 - елементарний заряд;
- елементарний заряд; 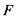 - число Фарадея;
- число Фарадея; 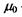 - хімічний потенціал розчинника;
- хімічний потенціал розчинника; 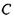 - концентрація розчиненої речовини (наприклад, певного іона);
- концентрація розчиненої речовини (наприклад, певного іона); 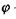 - потенціал електричного поля.
- потенціал електричного поля.
Вільна енергія Гельмгольця 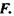 Для цього термодинамічного потенціалу маємо:
Для цього термодинамічного потенціалу маємо:
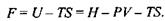
Відповідно
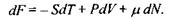 (5.6)
(5.6)
Звідси випливає, що для вільної енергії Гельмгольця природним набором незалежних змінних є 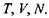 Необхідно відзначити також, що в природних умовах значно легше реалізувати вимогу постійності температури
Необхідно відзначити також, що в природних умовах значно легше реалізувати вимогу постійності температури 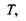 ніж ентропії
ніж ентропії 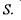 Тому два останніх термодинамічних потенціали - вільні енергії Гіббса
Тому два останніх термодинамічних потенціали - вільні енергії Гіббса 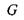 і Гельмгольця
і Гельмгольця 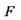 - знаходять більш широке застосування для опису медико-біологічних систем, оскільки для них ізотермічно-ізобарні або ізотермічно-ізохорні умови є найбільш природними. З наближенням до положення рівноваги вільні енергії Гіббса
- знаходять більш широке застосування для опису медико-біологічних систем, оскільки для них ізотермічно-ізобарні або ізотермічно-ізохорні умови є найбільш природними. З наближенням до положення рівноваги вільні енергії Гіббса 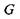 і Гельмгольця
і Гельмгольця 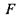 набувають своїх мінімальних значень.
набувають своїх мінімальних значень.
Дата добавления: 2020-11-18; просмотров: 672;











