ОРГАНИЗАЦИЯ И ФУНКЦИОНИРОВАНИЕ
ДЫХАТЕЛЬНОЙ ЦЕПИ
Окисление субстратов в процессе дыхания можно представить как перенос электронов и протонов (т. е. атомов водорода) от органических веществ на кислород. В этом процессе участвует ряд промежуточных переносчиков, образующих дыхательную цепь.
Дыхательная цепь (электронотранспортная цепь, цепь переноса электронов) - система трансмембранных белков и переносчиков электронов, которые передают электроны от субстратов на кислород. В клетках эукариот дыхательная цепь расположена во внутренней мембране митохондрий.
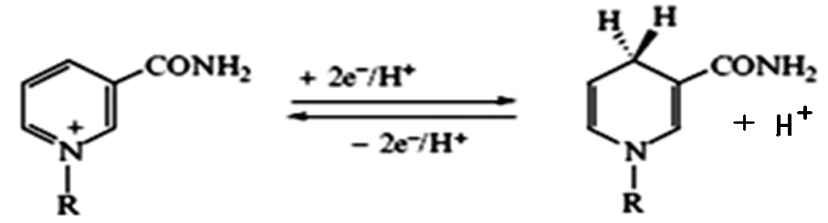
Восстановленный НАД служит универсальным донором атомов водорода для дыхательной цепи. При взаимодействии НАД+ и НАДФ+ с атомами водорода происходит обратимое присоединение атомов водорода. При этом в молекулу НАД+ (НАДФ+) включаются 2 электрона и один протон, а второй протон остается в среде:
Другим первичным источником атомов водорода и электронов служит восстановленный флавопротеин (ФАД или ФМН):
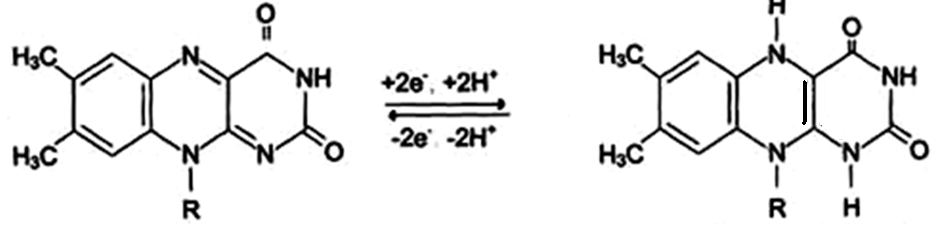
Восстановленные формы этих кофакторов способны транспортировать водород и электроны к дыхательной цепи митохондрий.
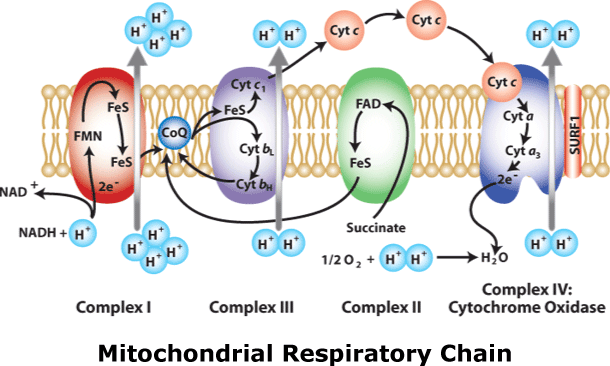
Компоненты дыхательной цепи встроены в митохондриальную мембрану в виде 4 белково-липидных комплексов (рис. 19).
|
| Рис. 19. Митохондриальная дыхательная цепь |
Комплекс I (НАДН-дегидрогеназа) включает ФМН и железосерный белок FeS (негемовое железо). Железосерный белок участвует в окислительно-восстановительном процессе. Комплекс I окисляет НАДН, перенося с него 2 электрона на KoQ. Комплекс I также перекачивает 4 протона из матрикса в межмембранное пространство митохондрии.
KoQ(убихинон) - производное бензохинона. Это некрупная липофильная молекула. Перемещаясь в липидном слое мембраны, убихинон обеспечивает передачу электронов между комплексами I - III и II - III.
Комплекс II (сукцинат-дегидрогеназа) включает ФАД и железосерный белок. Обеспечивает вход в цепь дополнительных электронов за счёт окисления сукцината.
Комплекс III (QН2-дегидрогеназа)включает цитохромы b и с1 и железосерный белок. Цитохромы- гемопротеины, в которых простетическая геминовая группа близка к гему гемоглобина (у цитохрома b идентична). Комплекс III переносит электроны с убихинона на цитохром с и перекачивает 2 протона в межмембранное пространство.
Комплекс IV (Цитохром c оксидаза)состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди. Комплекс IV катализирует перенос электронов с молекул цитохрома на O2 и перекачивает 4 протона в межмембранное пространство.
Цитохром а3 представляет собой терминальный участок дыхательной цепи- цитохромоксидазу,которая осуществляет окисление цитохрома с и образование воды. В организме человека митохондриальная дыхательная цепь образует 300-400 мл воды за сутки (метаболическая вода).
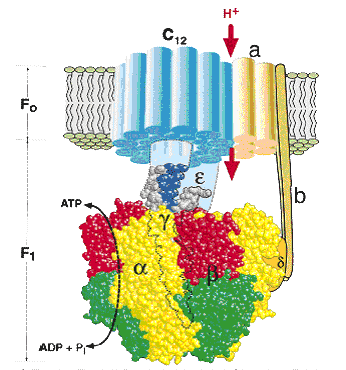
Компоненты дыхательной цепи митохондрий расположены в порядке убывания окислительно-восстановительного потенциала. Перемещение электронов в дыхательной цепи происходит но градиенту окислительно-восстановительного потенциала и является источником энергии для переноса протонов. Перенос двух электронов через каждый комплекс обеспечивает перекачку четырех протонов. В результате по сторонам мембраны возникает разность концентраций протонов и одновременно разность электрических потенциалов со знаком «плюс» на наружной поверхности. Электрохимический потенциал понуждает протоны двигаться в обратном направлении - с наружной поверхности внутрь. Однако мембрана непроницаема для них, за исключением участков, где располагается фермент протонная АТФ-синтаза (рис. 20). Она состоит из двух частей – статора и ротора.
Статор состоит из трех α-субъединиц и трех βсубъединиц – они участвуют непосредственно в синтезе АТФ из АДФ и фосфата. К ним примыкает δ-субъединица, и все вместе они образуют F1-субъединицу.
Ротор состоит из гамма и эпсилон субъединиц.
Статор держится в мембране, а ротор вращается за счет энергии протонов.
|
| Рис. 20. Строение протонной АТФ-синтазы. |
В статоре имеется протонный канал (F0). Он состоит из двух полуканалов, которые смещены один относительно другого. Протон проходит одну половину канала, затем на вращающемся роторе попадает во вторую половину канала. Возникающая при движении протонов через канал разность электрохимических потенциалов приводит в действие АТФ-синтазу, катализирующую реакцию:
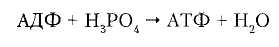
Хемиосмотическая концепцияпревращения энергии в живых клетках была выдвинута П. Митчеллом в 1960 г. для объяснения молекулярного механизма сопряжения транспорта электронов и образования АТФ в дыхательной цепи. За развитие исследований в области биоэнергетики П. Митчеллу в 1978 г. была присуждена Нобелевская премия.
В дыхательной цепи есть только 3 участка, где перенос электронов сопряжен с накоплением энергии, достаточным для образования АТФ. Коэффициент фосфорилирования - отношение величины образовавшегося АТФ к поглощенному кислороду: АТФ/О или Р/О. Максимальная величина коэффициента фосфорилирования 3, если реакция окисления идет с участием НАД, и 2, если окисление субстрата протекает через ФАД. Реально получаемые величины меньше (2,5 и 1,5). Т.е. процесс дыхания не полностью сопряжен с фосфорилированием. Степень сопряжения зависит главным образом от целостности митохондриальной мембраны.
Образующаяся АТФ при участии АДФ-АТФ-транслоказы транспортируется из матрикса на наружную сторону мембраны и попадает в цитозоль. Одновременно та же транслоказа переносит АДФ в обратном направлении, из цитозоля в матрикс митохондрии.
Общее содержание АТФ в организме 30-50 г, но средняя продолжительность жизни молекулы АТФ меньше 1 мин. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается.
На каждое сокращение сердечной мышцы расходуется около 2% имеющейся в ней АТФ. Вся АТФ израсходовалась бы за 1 мин, если бы не было ее регенерации. При образовании тромба в коронарной артерии поступление кислорода в клетки прекращается, соответственно прекращается и регенерация АТФ, и клетки погибают (инфаркт миокарда).
Увеличение концентрации АДФ приводит к ускорению дыхания и фосфорилирования. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем.
Для оценки влияния адениловых нуклеотидов на процессы метаболизма используют энергетический заряд клетки (ЭЗК):
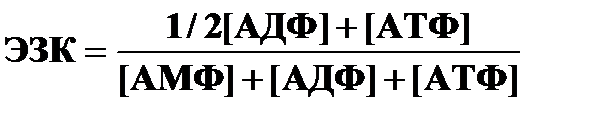
В норме ЭЗК=0,7-0,8: скорость образования АТФ равна скорости его использования, адениловая система насыщена энергией.
При ЭЗК<0,7 ускоряется образование АТФ путем увеличения скорости реакций общего пути катаболизма.
Если ЭЗК=1, то процессы синтеза АТФ тормозятся, и ускоряется ее использование.
Гипоэнергетическиесостояния подразделяются на:
- алиментарные (голодание, авитаминоз);
- гипоксические:
- нарушение поступления кислорода в кровь (легочная гипоксия),
- нарушение транспорта кислорода в ткани (гемодинамическая (кровопотеря, шок, пороки сердца) и гемоглобиновая (патология гемоглобина, блокирование его ядами) гипоксия),
- митохондриальные (затруднение использования кислорода в клетках) - нарушение функций митохондрий ингибиторами ферментов дыхательной цепи, разобщителями окисления и фосфорилирования, мембранотропными веществами.
При полном голодании пищевых резервов организма хватает на несколько недель, а кислорода - на 2-3 минуты. Поэтому гипоксия - наиболее частая причина гипоэнергетических состояний, а гипоксия мозга - непосредственная причина смерти. Поэтому среди реанимационных процедур ведущее место занимают меры, направленные на восстановление снабжения органов кислородом.
Дата добавления: 2016-07-27; просмотров: 2388;











