Основные зависимости и расчетные формулы
1. Для расчета концентраций компонентов в ректификационных колоннах используют уравнение Дальтона и закон Рауля.
Концентрации компонента в газовой фазе может быть выражена через его парциальное давление. На основании уравнений Клайперона и Дальтона мольная (объемная) доля у любого компонента смеси идеальных газов равняется:
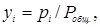 (5.1)
(5.1)
где рi – парциальное давление компонента газовой смеси; 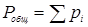 - общее давление смеси газов или паров, равное сумме парциальных давлений всей компонентов.
- общее давление смеси газов или паров, равное сумме парциальных давлений всей компонентов.
Закон Рауля:
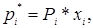 (5.2)
(5.2)
где рi* - парциальное давление компонента в парогазовой смеси над жидкостью в условиях равновесия; Рi – давление насыщенного пара чистого компонента – однозначная функция температуры; Р = f(t); x – мольная доля компонента в жидкости.
При подстановке в уравнение (5.2) значения 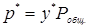 из уравнения (5.1) получаем условие равновесия системы жидкость-газ:
из уравнения (5.1) получаем условие равновесия системы жидкость-газ:
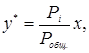 (5.3)
(5.3)
где у* - мольная доля компонента в парогазовой фазе, равновесной с жидкостью.
2. Уравнения материального баланса ректификационной колонны непрерывного действия:
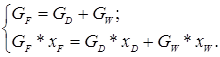
 (5.4)
(5.4)
где GF, GD, GW –массовые или мольные расходы питания, дистиллята и кубового остатка; xF, xD, xw – содержание низкокипящего компонента (НКК) в питании, дистилляте и кубовом остатке, массовые или мольные доли.
Обычно в задании известно количество сырья, поступающего в питание колонны и содержание легколетучего компонента в питании, дистилляте и кубовом остатке (xF, xD, xw). Решая систему уравнений (5.4), находим количество дистиллята и кубового остатка.
3. Температуры в кипятильнике и в верхней части колонны находим по следующим уравнениям:
для кипятильника (уравнение изотермы жидкой фазы)
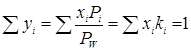 (5.5)
(5.5)
для верхней части колонны (уравнение изотермы газовой фазы)
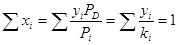 , (5.6)
, (5.6)
где Рi – давление паров чистых компонентов при рабочей температуре; ki – константа фазового равновесия i-ого компонента.
Константа равновесия индивидуального компонента определяется по уравнению: 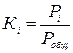 , при Робщ ≤ 5 ат. Если Робщ >5 ат, то К = f(fж;fп), где f - фугитивность
, при Робщ ≤ 5 ат. Если Робщ >5 ат, то К = f(fж;fп), где f - фугитивность
Расчет температуры в зоне питания зависит от доли отгона, которая находится из следующего уравнения:
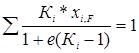 , (5.7)
, (5.7)
где Кi – константа фазового равновесия, е – доля отгона, xi,F – мольная доля компонентов в питании.
Это уравнение используется при малых долях отгона е.
При больших долях отгона большую точность дает следующее уравнение:
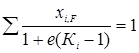 (5.8)
(5.8)
Из уравнений (5.7) и (5.8) методом последовательных приближений, задаваясь долей отгона, можно найти температуру, с которой смесь входит в зону питания. Или, задаваясь температурой, определить долю отгона и соответственно составы паровой и жидкой фазы.
Давление паров чистых компонентов и К находят из справочной литературы [8] или по уравнению Антуана:
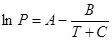 , (5.9)
, (5.9)
где Т – заданная температура, К; А, В, С – коэффициенты для индивидуального компонента [8,приложение А].
4. Для дальнейшего расчета необходимо знать физико-химические свойства веществ для найденных условиях (t и Р)F,D,W. Это такие свойства как теплоемкость пара и жидкости (СР), теплота испарения жидкости и теплота испарения паров (r), плотность пара и жидкости (ρ), динамический коэффициент вязкости (μ). Для нахождения этих свойств можно воспользоваться справочными данными или найти их методами прогнозирования [8,9,10].
5. Минимальное число флегмы Rмин в ректификационной колонне непрерывного действия для идеальной смеси определяют по уравнению:
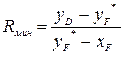 , (5.10)
, (5.10)
где уD — мольная доля низкокипящего компонента в дистилляте; xF — то же в исходной жидкости (питании) колонны; y*F — то же в паре, равновесном с жидкостью питания.
Рабочее (действительное) число флегмы:
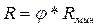 (5.11)
(5.11)
Здесь φ > 1 – коэффициент избытка флегмы.
При расчетах ректификационных колонн рабочее число флегмы часто определяют по формуле [11]:
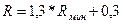 (5.12)
(5.12)
6. Методы определения числа теоретических тарелок
Эти методы применимы для расчета как тарельчатых, так и насадочных колонн; различие появляется лишь при определении фактического числа тарелок или высоты насадки.
Дата добавления: 2020-10-25; просмотров: 881;











