Внутренняя (полная) удельная поверхностная энергия
При образовании единицы поверхности S изменяется внутренняя поверхностная энергия.
Вернемся к объединенному уравнению первого и второго начал химической термодинамики для этого случая:
dU=TdS – pdV + σds +Σ μidni + φ dq (2.27)
где S – энтропия, μi – химический потенциал компонента, φ – потенциал поверхности.
При неизменном объеме системы V, постоянном составе вещества n, отсутствии заряда q на поверхности (V, n, q = const) получаем:
dU=TdS + σds. (2.28)
Проинтегрируем полученное уравнение от s до (s+1) (при образовании единичнгой поверхности):
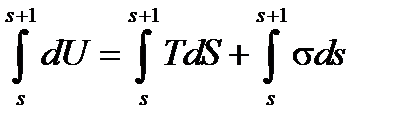 , (2.29)
, (2.29)
получаем: US= TSS + σ, (2.30)
где σ = GS, а TSS = qs– скрытая теплота образования единицы поверхности, величина qs всегда >0.
Внутренняя поверхностная энергия единицы поверхности больше поверхностной энергии Гиббса(*) на теплоту образования единицы поверхности. Поэтому ее обычно называют полной поверхностной энергией.
Запишем уравнение для изобарно-изотермического потенциала в дифференциальной форме:
dG= SdT –VdP, (2.31)
где S – энтропия системы; Т – температура, V – объем, P – давление.
Из этого уравнения следует, что температурная зависимость энергии Гиббса:
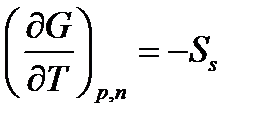 ; а т.к. σ = GS, то и
; а т.к. σ = GS, то и 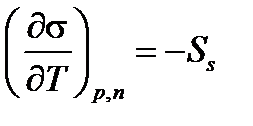 (2.32)
(2.32)
Отсюда qs = TS= 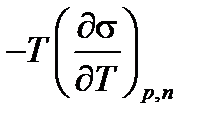 (2.33)
(2.33)
Для конденсированных систем из-за очень небольшой разницы в объемах полная внутренняя энергия U и энтальпия Н практически совпадают, поэтому уравнение Гиббса-Гельмгольца(**), связывающее полную поверхностную энергию или энтальпию с энергией Гиббса в этом случае можно записать:
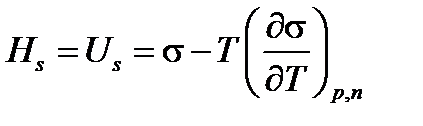 . (2.34)
. (2.34)
Как следует из уравнения (2.34), для определения Us или Нs надо знать σ и зависимость σ = f(Т). Конкретную зависимость можно определить только экспериментально.
Значения Us, Нs, qs для некоторых веществ приведены в табл. 2.3.
Таблица 2.3
Дата добавления: 2016-07-27; просмотров: 3421;











