ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
3.1. ТИАМИН (ВИТАМИН В1, АНТИНЕВРИТНЫЙ)
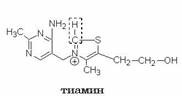
Строение. Химическая структура тиамина характеризуется наличием пиримидинового и тиазолового колец, соединенных метиленовой связью.
 Пищевые источники. Тиамин содержится в основном в оболочках зерновых культур, поэтому им богаты хлеб грубого помола, горох, фасоль, дрожжи. Хлеб из муки высокого помола содержит мало витамина В1. Водные растворы тиамина в кислой среде выдерживают нагревание до высоких температур без снижения биологической активности, поэтому при выпечке дрожжевого теста он сохраняется в готовом продукте. В нейтральной и особенно в щелочной среде витамин В1, наоборот, быстро разрушается при нагревании. Этим объясняется частичное и даже полное разрушение тиамина при кулинарной обработке пищи, например, при выпечке теста с добавлением в качестве рыхлителя гидрокарбоната натрия или карбоната аммония.
Пищевые источники. Тиамин содержится в основном в оболочках зерновых культур, поэтому им богаты хлеб грубого помола, горох, фасоль, дрожжи. Хлеб из муки высокого помола содержит мало витамина В1. Водные растворы тиамина в кислой среде выдерживают нагревание до высоких температур без снижения биологической активности, поэтому при выпечке дрожжевого теста он сохраняется в готовом продукте. В нейтральной и особенно в щелочной среде витамин В1, наоборот, быстро разрушается при нагревании. Этим объясняется частичное и даже полное разрушение тиамина при кулинарной обработке пищи, например, при выпечке теста с добавлением в качестве рыхлителя гидрокарбоната натрия или карбоната аммония.
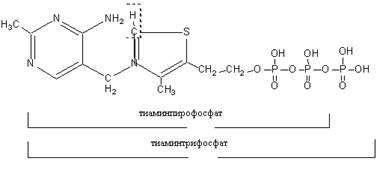
Метаболизм и функции. Тиамин всасывается в кишечнике с участием специального натрий-зависимого белка-переносчика. Процесс этот насыщаемый, поэтому в обычных условиях всасывается не больше 5 мг и назначение более высоких доз per os не имеет смысла. Всосавшийся тиамин подвергается фосфорилованию с образованием коферментной формы – тиаминдифосфата. Реакция катализируется тиаминдифосфаттрансферазой, в качестве донора фосфатной группы выступает АТФ. Тиамин в этой реакции получает от АТФ пирофосфатную группировку целиком.
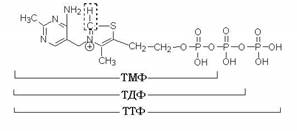
Рис. 3.1. Структура тиамина
В порядке убывания фосфорилирующей тиамин активности органы и ткани можно расположить следующим образом: печень, почки, сердце, семенники, головной мозг. Протеинизация ТДФ как кофермента осуществляется через пирофосфатную группировку и четвертичный азот тиазолового цикла. Обе метильные группы ответственны за сродство ТДФ к гидрофобным структурам апофермента. При этом обращенными к субстрату оказываются аминогруппа и второй углерод тиазола.
Тиаминпирофосфат выполняет метаболические функции, являясь составной частью следующих ферментов:
1. Дегидрогеназа пировиноградной кислоты осуществляет окислительное декарбоксилирование пирувата. Реакция контролирует процесс аэробного окисления углеводов и занимает ключевую позицию на путях превращения углеводов в липиды и катаболизма глюкозы через ЦТК. Фермент чувствителен к недостатку тиамина, в связи с чем гиповитаминоз сопровождается накоплением пирувата в крови и повышением его экскреции из организма. Большое значение пируватдегидрогеназная реакция имеет в поддержании определенного равновесия в обмене аминокислот, так как пируват является участником реакций трансаминирования, в результате которых он превращается в аминокислоту аланин.
2. Дегидрогеназа 2-кетоглютаровой кислоты по набору кофакторов и последовательности превращения субстрата очень похожа на пируватдегидрогеназу. Отличительной особенностью является то, что ТПФ более прочно присоединен к декарбоксилирующему домену. Это подчеркивает важность реакции для процессов жизнедеятельности и объясняет устойчивость фермента к недостаточности тиамина. Реакция имеет важное значение, так как осуществляет связь ЦТК с белковым обменом, в частности, с реакциями трансаминирования и аминирования кетокислот, в результате которых образуется глутамат.
3. Транскетолаза катализирует реакции переноса гликольальдегидного радикала от кетосахаров на альдосахара. Наиболее важное значение имеет взаимодействие ксилулозо-5-фосфата с рибозо-5-фосфатом или с эритрозо-4-фосфатом в пентозном цикле. Очевидно, что таким образом с транскетолазой тесно связаны процессы обеспечения организма пентозофосфатами и НАДФН+.
Таким образом, приведенные реакции демонстрируют важную роль тиамина в обмене углеводов и белков.
 При дефиците тиамина нарушается утилизация глюкозы и аминокислот с разветвленной цепью по аэробным путям. Наиболее чувствительными к дефициту тиамина являются клетки головного мозга, так как они используют в качестве энергетических субстратов глюкозу или аминокислоты с разветвленной цепью.
При дефиците тиамина нарушается утилизация глюкозы и аминокислот с разветвленной цепью по аэробным путям. Наиболее чувствительными к дефициту тиамина являются клетки головного мозга, так как они используют в качестве энергетических субстратов глюкозу или аминокислоты с разветвленной цепью.
Дата добавления: 2016-07-27; просмотров: 1261;











