Індикатори осаджувального титрування
В методах осаджувального титрування застосовуються для визначення кінцевої точки титрування індикатори–реагенти та адсорбційні індикатори. Осаджувальні – (K2CrO4); адсорбовані на осаді, що утворюється, (флуоресцеїн, еозин); комплексоутворюючі (напр.: Fe3++ SCN– → [Fe(SCN)]2+ (червоний)).
Індикатори–реагенти, так як і речовини, що визначаються, вступають в реакції з титрантом з утворенням осадів чи розчинних забарвлених сполук, забарвлення яких інакше, ніж забарвлення основного осаду чи розчину. Крім забарвлення, осад повинен мати більшу розчинність, ніж основний осад.
В методах осаджувального титрування застосовують такі прийоми:
Флуоресцеїн є продукт конденсації фталевого ангідриду з резорцином. У лужному середовищі флуоресцеїн існує у вигляді аніону, який інтенсивно флуоресціює жовто-зеленим світлом. Еозин – тетрабромфлуоресцеїн.

| 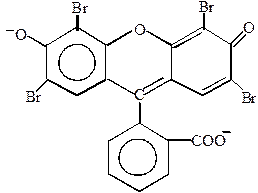
|
| флуоресцеїн | еозин |
Аргентометрія
Метод заснований на застосуванні як осаджувача стандартного розчину аргентум нітрату:
Ag+ + An– " AgAn$
Метод застосовується головним чином для кількісного визначення галогенід-іонів, а також для визначення йонів Аргентуму. При цьому робочим розчином є титрований розчин NaCl чи KCl.
Якщо робочим розчином є розчин AgNO3, то застосовують цей розчин з концентрацією с=0,1моль/дм3 або с=0,05моль/дм3. Розчин AgNO3 є вторинним стандартним розчином (готується не за наважкою, бо кристалічний AgNO3 не задовольняє вимогам до первинних стандартів). Стандартизується робочий розчин за хімічно чистими NaCl та KCl. Під дією світла AgNO3 розкладається.
Метод Мора
Титрантом методу є розчин AgNO3, с=0,05моль/дм3 або с=0,1моль/дм3. Індикатором є розчин K2CrO4. Його застосування засновано на тому, що при титруванні хлорид-іонів у присутності 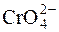 в першу чергу осаджуються йони Cl–. ДР(AgCl)=1,78·10–10. S(AgCl)=1,2·10–5моль/дм3. Після повного осадження хлорид-іонів надлишкова крапля розчину AgNO3 викликає утворення цегляно-червоного осаду Ag2CrO4. ДР(Ag2CrO4)=2,1·10–12; S(Ag2CrO4)=8,1·10–5моль/дм3.
в першу чергу осаджуються йони Cl–. ДР(AgCl)=1,78·10–10. S(AgCl)=1,2·10–5моль/дм3. Після повного осадження хлорид-іонів надлишкова крапля розчину AgNO3 викликає утворення цегляно-червоного осаду Ag2CrO4. ДР(Ag2CrO4)=2,1·10–12; S(Ag2CrO4)=8,1·10–5моль/дм3.
Метод Мора має ряд суттєвих недоліків:
1. Цей метод можна застосувати тільки для визначення хлоридів і бромідів і непридатний для визначення йодидів і роданідів, титрування яких супроводжується утворенням колоїдних систем і адсорбцією, що унеможливлює встановлення кінцевої точки титрування.
2. Метод не можна застосовувати в кислих і сильнолужних середовищах. У кислому середовищі хромат переходить в дихромат, який утворює з Ag+ червоний осад, що розчиняється в кислоті. У сильнолужному розчині утворюється Ag2O і AgOH. Тому pH середовища при титруванні повинен бути не менше 6,5 і не більше 10. У присутності солей амонію pH розчину повинен бути 6,5-7,2.
3. Йони Hg2+, Pb2+, Ba2+ і інші, які утворюють з хромат-іонами осади хроматів, заважають визначенню за методом Мора.
4. За методом Мора не можна титрувати забарвлені розчини, що маскують забарвлення аргентум хромату в точці еквівалентності.
5. Титруванню за методом Мора заважають аніони (S2–, PO43–, CO32–,
6. C2O42– та ін.), які утворюють з аргентум-іонами малорозчинні сполуки.
7. За цим методом суттєвою є індикаторна помилка, тому що розчин свідомо перетитровують.
Дата добавления: 2020-10-14; просмотров: 900;











