ВЕТЕРИНАРНО-БАКТЕРИОЛОГИЧЕСКАЯ ЛАБОРАТОРИЯ. ТЕХНИКА МИКРОСКОПИРОВАНИЯ. ОСНОВНЫЕ ФОРМЫ БАКТЕРИЙ. ОПРЕДЕЛЕНИЕ РАЗМЕРОВ МИКРООРГАНИЗМОВ
Ветеринарно-бактериологическая лаборатория. Это учреждение Государственной ветеринарной службы РФ. Различают районные, межрайонные, областные (краевые) и республиканские лаборатории. В их задачи входят: проведение бактериологических, серологических, вирусологических, микологических, биохимических, патологоанатомических и других исследований для установления лабораторного диагноза болезней животных всех видов, проведение экспертизы молока, мяса и других пищевых продуктов и кормов.
Лаборатории размещают в специальном здании с дифференциацией на отделы. Например, для межрайонных и районных ветеринарных лабораторий предусмотрены бактериологический, серологический и химико-токсикологический отделы. Выделяют помещение для вивария, где содержат экспериментальных животных (мыши, морские свинки, кролики и т. д.), а также баранакак донора крови, необходимой для приготовления питательных сред и постановки серологических реакций (РСК). Зараженных и здоровых животных содержат в разных комнатах вивария.
В бактериологической лаборатории оборудуют боксы. Под них отводят отгороженную стеклянной переборкой часть помещения или две-три смежные комнаты. В боксе работают, когда необходимо предотвратить контаминацию (загрязнение) окружающей среды патогенными микроорганизмами или исследуемых культур посторонней микрофлорой. Перед работой воздух и стенки бокса обеззараживают ультрафиолетовыми лучами бактерицидных ламп.
В отдельных помещениях лабораторного корпуса моют посуду, инструменты (моечная), готовят питательные среды (бактериологическая кухня), стерилизуют посуду, среды, спецодежду, обеззараживают культуры бактерий и инфекционный материал (автоклавная).
Правила техники безопасности в ветеринарно-бактериологической лаборатории. Работа в бактериологических лабораториях сопряжена с опасностью заразиться самим или заразить других патогенными микроорганизмами. Для студентов ветеринарных вузов лабораторией служит кафедра микробиологии. Сотрудники бактериологических лабораторий и кафедры микробиологии, аспиранты, студенты, приходящие на занятия или для работы в научно-студенческих кружках, обязаны ознакомиться с правилами техники безопасности и строго их соблюдать.
Входить в помещение лаборатории и работать в ней разрешается только в специальной одежде — халате и головном уборе (шапочка, косынка). Халат должен быть застегнут, волосы подобраны.
Не разрешается вносить посторонние предметы; личные вещи (портфели, сумки) оставляют в отведенных для этой цели местах.
Категорически запрещается курить и принимать пищу.
Перед началом работы проверяют исправность приборов (газовых и спиртовых горелок). О всех неисправностях сообщают ответственному лицу лаборатории, на учебных занятиях — преподавателю.
Не разрешается зажигать одну горелку от другой во избежание взрыва. Для зажигания горелок используют только спички.
Электроприборы включают с разрешения преподавателя или обслуживающего персонала кафедры. Запрещается касаться проводов и контактных частей электросети.
Рабочее место и оборудование содержат в чистоте, соблюдают опрятность в работе.
Исследуемый материал должен рассматриваться как особо опасный. При работе с ним необходимо соблюдать принятые в микробиологической практике технические правила, исключающие возможность заражения работника.
Движение культур микроорганизмов (посев, хранение, уничтожение) регистрируют согласно действующей инструкции в специальном журнале.
В случае попадания материала или культур микроорганизмов на пол, стол и т. д. обрабатывают эти поверхности дезинфицирующим раствором.
После окончания работы использованный материал (патологический материал, бактериальные, грибные культуры, инструменты и др.) студенты отдают преподавателю или лаборанту для обеззараживания, рабочее место тщательно убирают и дезинфицируют; моют и дезинфицируют руки, халаты и головные уборы складывают в полиэтиленовые пакеты.
После ознакомления с правилами техники безопасности на кафедре микробиологии студенты расписываются в журнале преподавателя.
Основное оборудование диагностических бактериологических лабораторий. Лаборатории в обязательном порядке оснащены следующим оборудованием.
Термостат используют для культивирования микроорганизмов в аэробных условиях. Это шкаф с двойными стенками, пространство между которыми заполнено водой или воздухом; снабжен устройством для поддержания постоянной температуры в диапазоне 28...43 °С (стабильную температуру лучше поддерживают водяные термостаты).
Микроанаэростаты необходимы для культивирования клеток в анаэробных условиях (см. тему 7); представляют собой герметические емкости, из которых с помощью насоса удаляют воздух и затем помещают в термостат.
Печь Пастера и автоклав служат для стерилизации инструментов, лабораторной посуды, питательных сред, спецодежды и т. д. Их устройство и принцип работы подробно изложены в теме 6.
Холодильники бытовые (4...6 °С) и низкотемпературные (-20 °С и ниже) используют для хранения питательных сред, культур микроорганизмов, вакцин, сывороток, поступившего для бактериологического исследования материала.
Центрифуги настольные, рефрижераторные (для разделения компонентов в условиях низких температур), микроцентрифуги предназначены для осаждения микроорганизмов, отделения форменных элементов от плазмы крови и др.
Помимо перечисленного оборудования в лаборатории необходимы: вакуумные насосы, дистиллятор, технические и аналитические весы, водяные бани, потенциометр, керамические, асбестовые и мембранные фильтры, аппараты для изготовления ватно-марлевых пробок, лабораторная посуда — чашки Петри, бактериологические и серологические пробирки, пластиковые планшеты для культуральных работ и микротитрования, колбы, мерные цилиндры, матрацы, градуированные и пастеровские пипетки, специальные инструменты — бактериологические петли, иглы, шприцы, пинцеты, шпатели, ножницы и т. д.
Техника микроскопирования. Микроскопы, дающие увеличение в сотни (световой) или тысячи раз (электронный), используют для изучения морфологии и строения микроорганизмов. Бактериологические лаборатории снабжены микроскопами различных типов: МБР-1, МБИ-1, МБИ-2, МБИ-3, МБИ-6, «Биолам», Р-1 и др.
Световой микроскоп. Основные узлы световых микроскопов показаны на рисунке 1.
К механическим частям микроскопа относят штатив, состоящий из основания и тубу содержателя. К тубусодержателю 12 прикреплены: тубус 14, револьвер 18— вращающийся диск с гнездами для объективов и предметный столик 20 с клеммами 5, фиксирующими предметное стекло с изучаемым объектом. Тубус передвигают вверх-вниз при помощи макро- 2 и микрометрического 1 винтов.
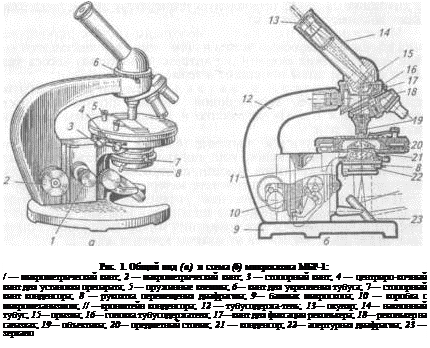
Оптическая часть микроскопа состоит из осветительного аппарата, зеркала, апертурной диафрагмы, конденсора, объективов и окуляров. Зеркало 23 подвижно закреплено под конденсором, одна его поверхность
плоская, другая — вогнутая. При работе с конденсором используют плоскую, без конденсора — вогнутую поверхность зеркала. Конденсор 21 применяют для концентрирования отраженных зеркалом лучей света, фокус которых должен находиться в плоскости препарата. Верхняя линза конденсора плоско-выпуклая, нижняя — двояковыпуклая. Под конденсором помещена апертурная (ирисовая) диафрагма 22. Изменяя диаметр отверстия, через которое проходит пучок света, регулируют интенсивность освещения поля зрения.
Объективы 19 состоят из нескольких линз, заключенных в металлическую оправу. Только одна линза — фронтальная — выполняет функцию увеличения, остальные предназначены для коррекции изображения. Под рабочим расстоянием объектива понимают расстояние от плоскости фронтальной линзы до изучаемого объекта при нахождении последнего в фокусе. Чем больше увеличение объектива, тем меньше рабочее расстояние и поле зрения. На корпусе объектива обозначены его увеличивающая способность (х8, х20, х40, х90) и числовая апертура.
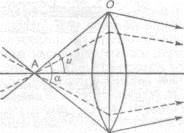
Числовая апертура отражает количество света, попадающего в линзу:
А = п sin и,
где А — числовая апертура линзы; п — показатель преломления среды, граничащей с линзой; и — половина отверстного угла а (рис. 2).
Окуляр 13 содержит глазную и собирательную линзы, которые увеличивают изображение, полученное при помощи объектива. На окулярах указано их увеличение (х5, х7, х10, х15). Общее увеличение микроскопа равно произведению увеличений окуляра и объектива: например, окуляр х10 и объектив х90 увеличивают объект в 900 раз. Важно получить не только увеличенное, но и четкое изображение исследуемого объекта. Четкость изображения зависит от разрешающей способности микроскопа, которую понимают как минимальное расстояние между двумя точками, при котором они видны раздельно.
Разрешающая способность микроскопа зависит от числовой апертуры пользуемого света. Например, апертура объектива х40 составляет 0,65, конденсора — 1,0, использован зеленый свет с длиной волны 0,55 мкм, отсюда разрешающую способность вычисляют по формуле
а = λ/(А1+А2),
где а — минимальное расстояние между двумя точками; Я —длина волны; Ах — числовая апертура объектива; Л2 — числовая апертура конденсора.
Рис. 2. Схема хода лучей при разном значении угла а:
А — объект; О — объектив; и — половина отверстного угла
Следовательно, в приведенном примере а = 0,55/(0,65 + 1,0) = = 0,33 мкм, т. е. при этих условиях предел разрешения равен 0,33 мкм.
Повысить разрешающую способность микроскопа можно за счет применения более коротких лучей света или, что более доступно, за счет приближения показателя преломления среды, граничащей с линзой, к аналогичному показателю стекла. С этой целью прослойку воздуха между линзой объектива и предметным стеклом замещают специальной жидкостью с показателем преломления, близким к показателю преломления стекла. Особенно это необходимо при использовании объективов большого увеличения (х 90 и больше) с фронтальными линзами малой площади. Показатель преломления стекла и воздуха составляет соответственно 1,52 и 1,0, поэтому в качестве иммерсионных жидкостей, создающих оптически однородную среду между предметным стеклом и линзой объектива, применяют чаще всего кедровое масло (л= 1,5), глицерин («= 1,4), воду («= 1,3). Ход лучей света при использовании обычного (сухого) и иммерсионного объективов показан на рисунке 3. Объективы для масляной иммерсии обозначают МИ, водной — ВИ.
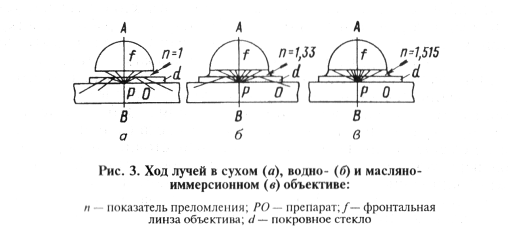
Если апертура конденсора меньше апертуры рабочего объектива, то из-за слабого потока света возможности линзы объектива задействованы не полностью. Если апертура объектива меньше, чем апертура конденсора, что характерно для объективов малого увеличения, то уменьшают диаметр отверстия ирисовой диафрагмы конденсора.
Микроскопы необходимо хранить под чехлами или колпаками для защиты от пыли. Для наружной очистки оптики применяют смоченные спиртом мягкие ткани, не оставляющие после себя волокон. Использование ксилола и бензина для этих целей может привести к расклеиванию линз.
При микроскопировании существенное значение имеет освещение исследуемого объекта. Освещение чаще устанавливают по методу Келлера.
Осветитель (желательно использовать стандартные осветители ОИ-7 и ОИ-19, содержащие микролампу с небольшой плотно скрученной спиралью, которую можно передвигать вдоль оси осветителя) располагают на расстоянии 30...40 см от микроскопа.
На предметный столик ставят препарат, в рабочее положение переводят объектив х8.
3. Конденсор поднимают до упора, полностью открывают
ирисовую диафрагму.
Зеркало устанавливают плоской поверхностью и почти полностью закрывают диафрагму осветителя.
 |
На зеркало помещают лист белой бумаги и, передвигая патрон осветителя, добиваются четкого изображения на бумаге нити накала лампы.
Глядя в окуляр, при помощи зеркала получают в центре поля зрения изображение краев диафрагмы осветителя — светлое пятно с нерезко очерченными краями.
Используя объектив х 8, фокусируют объект в области светлого пятна.
Опуская конденсор, в плоскости препарата фокусируют изображение краев диафрагмы осветителя и движением зеркала переводят светлое пятно в центр поля зрения.
Диафрагму осветителя открывают до тех пор, пока светлое пятно не закроет все поле зрения.
10. В дальнейшем положение зеркала, конденсора и диафрагмы осветителя больше не меняют.
В работе с учебными микроскопами освещение нередко устанавливают упрощенным способом. Приступая к работе с микроскопом, проверяют состояние конденсора: он должен быть поднят до уровня предметного столика, диафрагма открыта. Приподняв тубус микроскопа, устанавливают объектив с наименьшим увеличением (х8, х10); глядя в окуляр, при помощи зеркала добиваются полного освещения поля зрения. Затем на исследуемый препарат наносят каплю кедрового масла (или его заменителя), помещают препарат на предметный столик, поворотом револьвера устанавливают иммерсионный объектив. (Чтобы избежать соприкосновения объектива со столиком, тубус следует держать приподнятым.) Под контролем глаза (смотреть сбоку) фронтальную линзу объектива легким поворотом макрометрического винта погружают в каплю иммерсионного масла и, наблюдая в окуляр, осторожно поднимают тубус до видимости препарата. Затем легкими поворотами микрометрического винта (вперед-назад) регулируют четкость изображения.
В конце работы тубус приподнимают макровинтом, револьвер переводят в нейтральное положение, масло с линзы осторожно снимают мягкой хлопчатобумажной тканью. Микроскоп убирают в деревянный футляр или накрывают стеклянным колпаком (лучше из цветного стекла) для защиты от света.
Микроскопированием определяют морфологические особенности микроорганизмов, их тинкториальные свойства, подвижность, наличие специальных структурных элементов (спора, капсула).
Чтобы исследовать под микроскопом живые нефиксированные неокрашенные микроорганизмы, используют особые оптические системы: фазово-контрастное устройство и темнопольный конденсор.
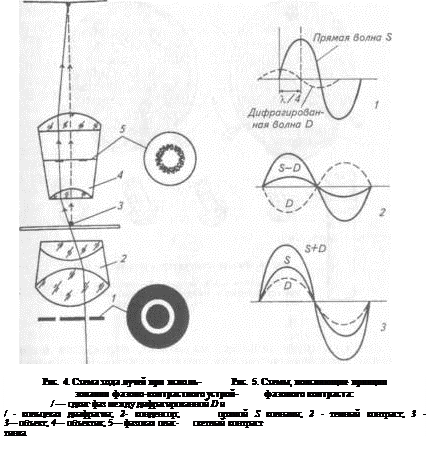
Фазово-контрастное устройство. Включает в себя: а) фазовую пластинку — расположенный в задней фокальной плоскости объектива прозрачный диск, на поверхность которого напылено кольцо из металлов (фазовое кольцо); б) кольцевую диафрагму — помещенную под конденсором светонепроницаемую пластину с прозрачным кольцевидным участком.
Световая волна при прохождении через живую клетку отстает по фазе приблизительно на '/4 длины волны и дополнительно сдвигается еще на 'Д после прохождения через фазовую пластинку. Ход лучей в фазово-контрастном устройстве показан на рисунках 4, 5. Сдвинутые по фазе после прохождения через фазовую пластинку лучи либо совпадают и складываются с прямыми лучами, идущими мимо объекта, либо оказываются в противофазе. В первом случае исследуемый объект виден как светлый на темном фоне, а во втором — как темный на светлом фоне. В микробиологии широко применяют фазово-контрастное устройство КФ-4 (рис. 6) (объект виден темным на светлом фоне). Далее приведена последовательность перехода к работе с фазово-контрастным устройством.
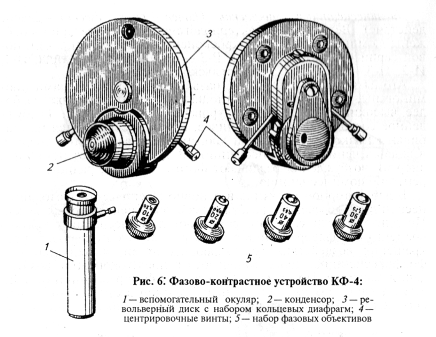
Обычный конденсор заменяют на фазово-контрастный, а объектив х40 — на аналогичный фазовый объектив.
Диск револьвера конденсора поворачивают до появления в окошечке цифры 0; диафрагму конденсора полностью открывают.
Используя объектив х8, устанавливают освещение по Келлеру.
Обычный окуляр заменяют на вспомогательный и с помощью тубуса добиваются четкого изображения фазовой пластинки в виде темного кольца.
5. Устанавливают кольцевую диафрагму, соответствующую
объективу х40. В этом случае наряду с темным кольцом фазовой пластинки можно видеть светлое кольцо диафрагмы.
При помощи центрировочных винтов совмещают фазовое кольцо и кольцо диафрагмы.
Вспомогательный окуляр заменяют обычным и микроскопируют препарат. При работе с другими объективами устанавливают соответствующие диафрагмы.
Темнопольный конденсор. При темнопольной микроскопии используют специальный конденсор с затемненной центральной частью, поэтому в плоскость объекта идут только боковые лучи, отраженные от внутренних зеркальных поверхностей конденсора. Лучи направлены под таким углом, что не попадают в линзу объектива, и поэтому поле зрения выглядит темным (рис. 7). Та часть лучей, которая попадает на объект, отражается в линзу объектива, что позволяет видеть светлое изображение объекта на темном фоне.
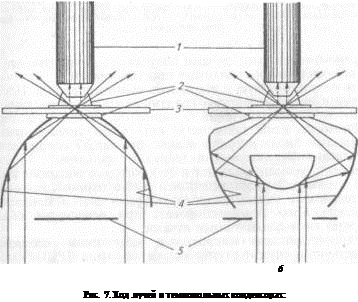 |
Чтобы перейти к методу темнопольной микроскопии, поступают следующим образом.
Вынимают окуляр, светлопольный конденсор и вывинчивают один из объективов (х 8).
Прикрывают диафрагму осветителя и фокусируют нить накала лампы на листе белой бумаги, помещенном на зеркале (см. п. 5 Установки освещения по Келлеру).
Раскрывают диафрагму осветителя, закрывают матовым стеклом конец тубуса и с помощью зеркала добиваются равномерного освещения поля зрения.
Ставят на место окуляр, объектив х8, темнопольный конденсор, положение зеркала при этом не меняют.
На линзу конденсора наносят каплю дистиллированной воды, на столик помещают препарат «раздавленная капля» таким образом, чтобы вода на линзе конденсора контактировала с нижней поверхностью предметного стекла.
Глядя в окуляр, при помощи центрировочных винтов переводят в центр поля зрения светлое кольцо с темным пятном в центре. Далее регулируют видимость объекта в поле зрения.
Люминесцентный микроскоп {lumen — свет, escennt — слабое действие). Ветеринарно-бактериологические лаборатории снабжены люминесцентными микроскопами серии МЛ (рис. 8) и новой серии «Люмам» (Р-1, Р-2, Р-3 — модели рабочего типа; И-1, И-2, И-3 — модели исследовательского типа).
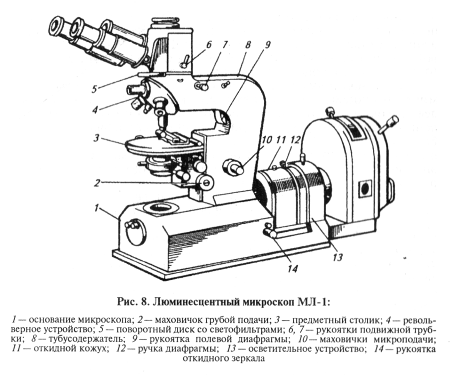
Атомы некоторых веществ, называемых люминофорами (люминогены, флуорохромы), поглощая энергию, переходят на более высокий энергетический уровень (возбуждаются). Возбужденное состояние слабоустойчивое, атомы возвращаются на стабильны низкоэнергетический уровень, отдавая избыток энергии в виде свечения — люминесценции. В зависимости от источника энергии возбуждения различают фото-, электро-, радио-, хемо-, рентгенолюминесценцию.
В лабораторной практике в основном используют фотолюминесценцию—свечение, возбуждаемое энергией световых лучей. По длительности свечения различают люминесценцию кратковременную—флуоресценцию, быстро затухающую после прекращения воздействия возбуждающих лучей, и длительную — фосфоресценцию, продолжающуюся и после окончания возбуждения вещества. По правилу Стокса свет флуоресценции отличается от света возбуждения большей длиной волны, поэтому при освещении объекта невидимыми ультрафиолетовыми или короткими сине-фиолетовыми лучами получают длинноволновые свечения объектов, хорошо видимые простым глазом.
Различают первичную и вторичную люминесценцию. Первичная люминесценция присуща практически всем веществам, однако интенсивность свечения большинства из них невелика. В микробиологии чаще применяют вторичную люминесценцию: обрабатывают биологический объект (препарат) специальными красителями — флуорохромами (акридин оранжевый, аурамин, флуоресцеин, уранин, родамин и др.), которые обладают интенсивной первичной люминесценцией. Флуорохромы, связываясь с определенными химическими структурами клетки, придают им способность ярко люминесцировать при освещении объекта (препарата) сине-фиолетовыми лучами/В люминесцентных микроскопах источником возбуждения люминесценции служит ртутно-кварцевая лампа ДРШ-250. Чтобы провести успешную люминесцентную микроскопию: 1) из светового потока, идущего от ртутно-кварцевой лампы, с помощью специальных светофильтров выделяют коротковолновую (сине-фиолетовую) часть спектра для возбуждения свечения изучаемого объекта и отсекают лучи той же длины, что и лучи люминесценции (в противном случае все поле зрения будет интенсивно светиться). Для этого между источником света и исследуемым объектом ставят светофильтры типов УФС-3, ФС-1, СС-4 и др., которые называют «возбуждающими» светофильтрами; 2) из светового потока, идущего от изучаемого объекта в окуляр, пропускают длинноволновое свечение (люминесценцию) и одновременно защищают глаз наблюдателя от коротковолновых (возбуждающих) лучей. С этой целью между объектом и глазом наблюдателя помещают окулярные (запирающие) светофильтры типов ЖС-3, ЖС-18, Т-1Н и Т-2Н.
Сочетанное применение в оптической системе люминесцентного микроскопа фильтров целевого назначения (возбуждающие, запирающие) называют принципом скрещенных фильтров. Эффект скрещенных светофильтров обеспечивает цветную флуоресценцию объектов на темном фоне поля зрения (зелено-желтую).
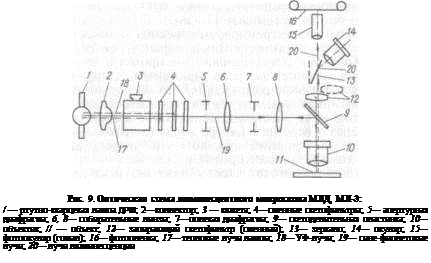 |
Ход лучей в люминесцентном микроскопе показан на рисунке 9. Лучи от лампы ДРШ попадают на светоделительную пластинку, расположенную между объективом и окуляром. Ненужные длинноволновые лучи проходят через светоделительную пластинку и гаснут в кожухе микроскопа. Возбуждающие коротковолновые лучи пластинка отражает на изучаемый объект. Часть возбуждающих лучей трансформируется на объекте в длинноволновые лучи люминесценции, которые проходят через объектив, светоделительную пластинку, запирающие фильтры и попадают в глаз наблюдателя. Другую часть возбуждающих лучей, не претерпевших изменений, светоделительная пластинка отражает в сторону источника света —лампы ДРШ. Такое дифференцирующее свойство светоделительной пластинки обусловлено тем, что она покрыта несколькими слоями диэлектриков и расположена под углом 45° по отношению к падающим на нее лучам.
Существенное отличие серии «Люмам» от МЛ — наличие у «Люмам» сменных светоделительных пластин с разными параметрами возбуждающего спектра и спектра люминесценции, комбинируемых с соответствующими запирающими фильтрами и фильтрами возбуждающего света.
При люминесцентной микроскопии в качестве иммерсионной жидкости используют специальное нефлуоресцирующее масло (обычное иммерсионное масло для этих целей непригодно из-за собственной люминесценции).
Преимущество люминесцентной микроскопии заключается в том, что она дает цветное изображение, высокую степень контрастности, возможность обнаруживать в исследуемом материале бактерии в небольших количествах. В микробиологии нашли применение такие виды исследований, как люминесцентная микроскопия флуорохромированных объектов и метод флуоресцирующих антител (МФА) в экспресс-диагностике инфекционных болезней.
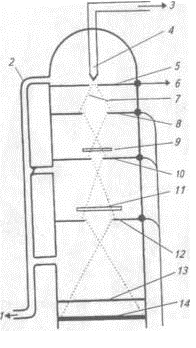
Электронный микроскоп. Длина волн видимой области спектра лежит в пределах 0,4...0,7 мкм, следовательно, максимальное разрешение (половина длины волны), которое можно получить при помощи светового микроскопа, — около 0,2 мкм (200 нм). Волновые свойства также присущи электронам. При напряжениях 50 ООО... 100 ООО В длина волны электрона составит 0,0055... 0,0039 нм. По чисто техническим причинам получить теоретически максимальное разрешение, равное 0,002 нм, невозможно, и на практике оно не превышает 1...2 нм.
 |
Основная часть электронного микроскопа включает в себя ряд магнитных линз, люминесцентный экран и фотографическую пластинку (рис. 10). Электрический ток проходит через вольфрамовую нить и вызывает эмиссию электронов. К нити приложено высокое отрицательное напряжение, что обеспечивает большую разницу потенциалов между нитью и заземленной пластиной анода. В этом поле электроны движутся к аноду, часть из них проходит через отверстие в центре анода (центральная апертура) и формирует электронный луч, который фокусируется первой магнитной линзой (конденсорной) и освещает объект. Большая часть электронов проходит через объект без отклонения, часть электронов после столкновения с тяжелыми атомами выбивается из общего электронного луча. В итоге образуется такая структура электронного луча, которая при дополнительной фокусировке дает изображение
объекта. Электроны, прошедшие через объект, фокусируются объективной магнитной линзой, которая дает увеличенное изображение; третья магнитная линза (проекционная), в свою очередь, также увеличивает изображение, которое и попадает на экран. Если люминесцентный экран убрать, то луч попадает на фотопластинку.
Электронный микроскоп, создающий изображение при прохождении электронов через тонкопленочный образец, называют трансмиссионным или просвечивающим.
В сканирующем электронном микроскопе первичный электронный луч, попадая на поверхность фиксированного, высушенного и покрытого тонким слоем металла объекта, вызывает различные вторичные излучения, интенсивность которых зависит от характеристик рельефа, электропроводности и химического состава. Полезное увеличение сканирующей электронной микроскопии обычно не превышает 50 000 раз. С ее помощью получают трехмерное изображение объекта (рис. 11).
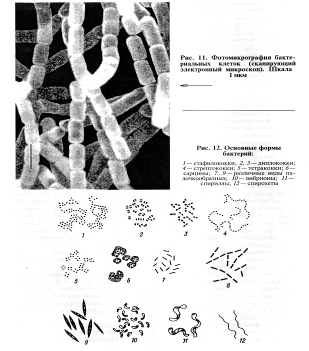
Основные формы бактерий. Форма бактерий различных таксономических групп разнообразна (рис. 12), и ее обязательно учитывают при идентификации микроорганизма.
Кокки. Это бактерии шаровидной формы. В зависимости от взаимного расположения клеток различают микрококки— отдельно лежащие кокки, диплококки — парно расположенные кокки, стрептококки — цепочки кокков, стафилококки— скопление кокков в виде виноградной грозди, тетракокки — структуры из четырех кокков, сарцины — многослойные структуры из 8... 16 кокков.
Палочковидные бактерии. Клетки цилиндрической формы, могут располагаться одиночно, парами — диплобактерии, Цепочками — стрептобактериИ. Палочковидные бакте рии, образующие в неблагоприятных условиях специфическую форму существования — спору, диаметр которой не превышает диаметр клетки (аэробные палочковидные бактерии), называют бациллами. Если диаметр споры в клетке существенно превышает ее поперечный диаметр, то такие спорообразующие бактерии называют клостридиями (анаэробные палочки).
Извитые (спиралевидные) бактерии. К ним относят вибрионы, спириллы и спирохеты. Вибрионы — клетки в форме слегка изогнутых палочек; спириллы — бактерии, образующие до 6 завитков; спирохеты — бактерии со множеством (свыше 6) мелких завитков и в отличие от спирилл без жгутиков.
Ветвящиеся бактерии. Выраженная способность к ветвлению отмечена у прокариот из группы актиномицет; тенденцию к ветвлению на отдельных стадиях развития проявляют и другие бактерии, например микобактерии.
Бактерии без постоянной формы. Микоплазмы лишены клеточной стенки, поэтому их форма легко изменяется.
У большинства бактериальных клеток нет дифференциации на передний и задний концы, нижнюю и верхнюю стороны, т. е. функционально они равноценны, хотя есть исключения.
Полиморфизм. Это свойство некоторых видов бактерий в процессе роста на питательных средах образовывать формы, отличающиеся от типичной.
Определение размеров микроорганизмов. Размеры бактерий варьируют в широких пределах — от 0,2 мкм (микоплазмы) до 125 мкм {Ochromotium oxaliferum). Размеры большинства патогенных бактерий составляют от нескольких десятых микрометра до нескольких микрометров.
При характеристике размеров бактерий обычно указывают длину и ширину клетки в микрометрах (10~3мм). В качестве инструментов измерения используют окуляр- и объект-микрометры..
Окуляр-микрометр. Это стеклянная пластинка, на которой линия в 5 мм разделена на 10 или 20 делений (размещают в окуляре).
Объект-микрометр. Представляет собой предметное стекло с линией длиной 0,5 или 1,0 мм, разделенной на сотые доли (рис. 13, 14).
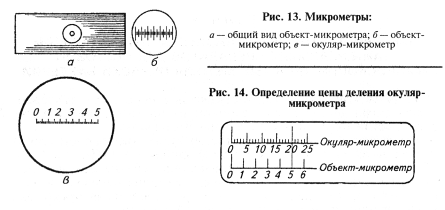
Объект-микрометр помещают на предметный столик и, глядя в окуляр с окуляр-микрометром, совмещают начальную черту в объект- и окуляр-микрометрах. Затем определяют цену деления окуляр-микрометра при данных окуляре и объективе. Например: шкала объект-микрометра составляет 1 мм и одно ее деление равно 10-2 мм, т.е. 10мкм.
При совмещении шкалы объект-микрометра три его деления (т. е. 30 мкм) соответствуют 14 делениям окуляр-микрометра, отсюда одно деление окуляр-микрометра составляет 30: 14 = 2,14 мкм. После того как определена цена одного деления окуляр-микрометра, вместо объект-микрометра помещают препарат с исследуемым объектом. Например, палочковидный микроб по длине занимает 3, а по ширине — 0,5 деления окуляр-микрометра. Если одно деление окуляр-микрометра составляет 2 мкм, то длина бактериальной клетки будет 3-2 = 6 мкм, а ширина — 0,5 • 2 = 1 мкм.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Ознакомиться с бактериологической лабораторией, ее основным оборудованием, правилами техники безопасности.
Изучить устройство светового микроскопа, установку освещения по Келлеру, принципы фазово-контрастной, темнопольной, люминесцентной и электронной микроскопии.
3. Освоить приемы работы с иммерсионным объективом микроскопа.
Провести микроскопию препаратов с бактериями различной формы.
Определить размеры бактериальных клеток.
Контрольные вопросы
1. Каковы основные правила работы в бактериальной лаборатории?
2. Как проходят лучи в иммерсионной системе, фазово-контрастном устройстве микроскопа, темнопольном конденсоре, люминесцентном микроскопе?
3. Каковы основные формы бактерий?
4. Как определяют размеры микроорганизмов?
Тема 2
БАКТЕРИОЛОГИЧЕСКИЕ КРАСИТЕЛИ. ПРИГОТОВЛЕНИЕ БАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ ДЛЯ СВЕТОВОЙ МИКРОСКОПИИ. ПРОСТЫЕ МЕТОДЫ ОКРАСКИ БАКТЕРИЙ
Цель занятия. Ознакомить студентов с основными бактериологическими красителями, техникой их приготовления и методом простой окраски бактериальных препаратов.
Оборудование и материалы. Набор сухих бактериологических красок и их растворов, культуры бактерий на МПА и в МПБ (Е. coli, S. aureus), световые микроскопы, обезжиренные предметные стекла, фуксин Пфейффера, красящие бумажки по Синеву, раствор метиленового синего, фильтровальная бумага для высушивания мазков, физиологический раствор.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Обычно форму, взаимное расположение, некоторые особенности химического состава и строения бактериальных клеток определяют путем микроскопии окрашенных препаратов. Оптическая плотность неокрашенных бактерий близка к оптической плотности стекла, поэтому бактерии плохо различимы при микроскопиро-вании. Окрашенные клетки, наоборот, четко видны. Кроме того, болезнетворные микроорганизмы в процессе обработки инактивируются, что делает препарат безопасным для исследователя.
Отношение к различным красителям и методам окраски называют тинкториальными свойствами микроорганизмов.
Бактериологические красители. Для окрашивания бактериальных клеток применяют синтетические анилиновые красители, которые дифференцируют на основные и кислые. У основных красителей ионом, придающим бактериальной клетке окраску, служит катион, у кислых — анион. Структуры бактерий, взаимодействующие с красителем, преимущественно отрицательно заряжены и поэтому лучше воспринимают основные красители.
Основные красители. Красные (нейтральный красный, пиро-нин, сафранин, основной фуксин); фиолетовые (генциан фиолетовый, кристаллический фиолетовый, гематоксилин, тионин); синие (виктория, метиленовый синий); зеленые (малахитовый зеленый, метиленовый зеленый, янус зеленый); коричневые (везувин, хризоидин); черные (индулин).
Кислые красители. Розовые и красные (кислый фуксин, эозин, эритрозин, гропеолин); желтые (аурантил, конго, пикриновая кислота); черные (нигрозин).
Спиртовые растворы. Эти растворы длительного хранения готовят из сухих порошковых красок. Растворы сначала выдерживают в термостате для лучшего растворения веществ, затем фильтруют через бумажные фильтры, чтобы избавиться от нерастворившихся микрочастиц, которые при окраске препаратов оседают на клетках, тем самым затрудняя их изучение под микроскопом.
Далее приведены рецепты спиртовых растворов красок, наиболее часто применяемых в микробиологии.
Карболовый фуксин Циля: раствор А: основной фуксин —0,3 г, 96%-й этанол —10 мл; раствор Б: фенол — 5 г, вода дистиллированная — 95 мл. Растворы А и Б смешивают.
Фуксин Пфейффера — это фуксин Циля, разведенный водой в соотношении 1 : 10 (из-за нестойкости используют только в течение рабочего дня).
Карболовый кристаллический фиолетовый: раствор А: кристаллический фиолетовый — 0,4 г, 96%-й этанол — 10 мл; раствор Б: фенол — 1 г, вода дистиллированная — 100 мл. Растворы А и Б смешивают.
Щелочной метиленовый синий Леффлер а: раствор А: метиленовый синий — 0,3 г, 96%-й этанол — 30 мл; раствор Б: 0,01%-й раствор гидроксида калия — 100 мл. Растворы А и Б смешивают.
Водные растворы. Так как эти растворы красителей нестойкие, их готовят непосредственно перед использованием (ex tempore).
Раствор сафранина: сафранин — 2 г, вода дистиллированная горячая (/= 90 °С) — 100 мл. Раствор фильтруют через бумажный фильтр.
Раствор малахитового (бриллиантового) зеленого: малахитовый зеленый — 1 г, вода дистиллированная горячая —100 мл. Раствор фильтруют через бумажный фильтр.
Раствор Люголя — стойкий раствор используют для окраски по методу Грама: йод кристаллический — 1 г, йодид калия—2 г, вода дистиллированная — 10 мл. Смесь выдерживают 24 ч при 37 °С, после чего добавляют дистиллированную воду до 300 мл и одну-две капли глицерина.
Приготовление бактериальных препаратов для световой микроскопии. Приготовление окрашенных бактериальных препаратов включает в себя приготовление мазка, его высушивание, фиксацию и окрашивание. Материалом для исследования служат культуры бактерий на плотных или жидких питательных средах или нативный материал: органы, ткани, воспалительный экссудат и т. д. Препараты готовят на чистых, обезжиренных предметных стеклах.
На предметное стекло наносят исследуемый материал. Если материал жидкий и находится в бактериологической пробирке (бульонная культура), то пробирку берут в левую руку, в правую — бактериологическую петлю (как пишущее перо), прожигают ее в пламени горелки, мизинцем правой руки захватывают пробку и над пламенем горелки извлекают ее из пробирки, края пробирки обжигают. Петлей, не смачивая петледержатель, берут материал и распределяют на предметном стекле по площади размером 2 см2. Края пробирки вновь обжигают, закрывают ее пробкой, обжигают бактериологическую петлю.
Аналогичным образом готовят мазок из агаровой культуры, осторожно захватывая петлей бактериальную массу с поверхности питательной среды. На предметное стекло в этом случае предварительно наносят каплю стерильного физиологического раствора, в котором петлей суспендируют бактериальную массу.
Из животных тканей готовят мазки-отпечатки: стерильно вырезают кусочек органа, поверхностью среза несколько раз касаются поверхности предметного стекла.
Приготовленный мазок высушивают на воздухе.
Мазок фиксируют для прикрепления бактериальных клеток к поверхности стекла и их инактивации. Применяют физический и химический способы фиксации. При физическом способе препарат обратной стороной стекла два-три раза медленно проводят над пламенем горелки. Чрезмерное нагревание вызывает изме
Дата добавления: 2016-07-22; просмотров: 7665;











