Регуляция сродства гемоглобина к кислороду
Степень сродствагемоглобина к кислороду зависит от ряда факторов, в том числе от способности гемоглобина связываться с2,3-дифосфоглицератом (2,3-ДФГ).
2,3-дифосфоглицерат образуется в эритроцитах в ходе анаэробного метаболизма.
Образовавшиеся молекулы 2,3-ДФГ связываются с молекулами гемоглобина, занимая место в его центральной полости.
Так как гемоглобин является аллостерическим белком – высокомолекулярным образованием, свойства которого зависят от пространственного расположения определенных групп молекулы, вхождение 2,3-ДФГ в молекулу гемоглобина снижает его способность присоединять кислород – снижает сродство гемоглобина к кислороду.
В связи с различиями структуры глобина в гемоглобине А и гемоглобине F 2,3-ДФГ образует с гемоглобином плода менее прочное соединение, чем с гемоглобином взрослого. Это обусловлено тем, что молекула 2,3-дифосфоглицерата, имея выраженный отрицательный заряд (рис. II-6), обладает высокой способностью связываться с Нb А, располагаясь в его положительно заряженной центральной полости. Положительный заряд центральной полости Нb А формируется аминогруппами остатков аминокислот валина, лизина и гистидина. В Нb F положительный заряд полости существенно нивелируется отрицательно заряженными остатками серина, поэтому 2,3-дифосфоглицерат связывается с Нb F в значительно меньшей степени, чем с Нb А. Следовательно, сродство Нb F к кислороду выше, чем гемоглобина взрослого. Поэтому гемоглобин плодазабирает кислород из крови матери, протекающей по сосудам плаценты.
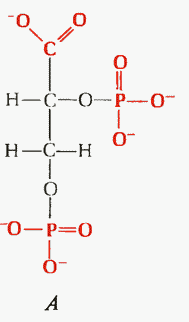
Рис. II-6. Структура 2,3-дифосфоглицерата
Содержание гемоглобина в крови
у мужчин у женщин
132-164 г/л 115-145 г/л
О гликозилированном гемоглобине
Гемоглобин способен гликозилироваться – необратимо связываться с глюкозой в количестве, пропорциональном содержанию глюкозы в крови. В норме гликозилированный гемоглобин (НbА1с) составляет 3,5-5,6 % от количества гемоглобина в крови. Этот показатель используется в качестве контроля состояния больных сахарным диабетом.
Дата добавления: 2020-10-14; просмотров: 1162;











