Технологические показатели качества воды
Сухой остаток определяют, упаривая 1 л профильтрованной воды, подсушивая остаток при 105 °С и взвешивая его. При этом необходимо учитывать, что в указанных условиях термический распад бикарбонатов протекает с выделением СО2, т. е. вместо каждых 122 мг бикарбонат-ионов в составе сухого остатка остается 60 мг карбонат-ионов. В реальных условиях сухой остаток может оказаться несколько больше расчетного значения солесодержания (т. е. суммы концентраций отдельных ионов) из-за того, что некоторые соли при температуре 105 °С удерживают часть кристаллизационной воды и в сухом остатке присутствуют коллоидные, в том числе и органические, примеси. Поэтому сухой остаток нужно рассматривать как показатель, лишь приближенно характеризующий загрязненность воды и дающий порядок его величины.
Плотный осадок определяют, подсушивая при 105 °С упаренный остаток нефильтрованной воды, содержащей также и грубодисперсные примеси, концентрацию которых можно найти по разности плотного и сухого остатков воды.
Общей щелочностью воды (Щ0), мг-экв/кг, называют сумму миллинормальных концентраций всех анионов слабых кислот и гидроксильных ионов за вычетом концентрации ионов водорода:
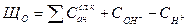 (11)
(11)
В зависимости от типа анионов, обусловливающих щелочность, различают щелочность бикарбонатную, карбонатную, силикатную, гидратную, фосфатную:
Що=Щб+Щк+Щс+Щф+Щг (12)
В большинстве природных вод концентрация бикарбонат-иона преобладает над концентрациями других анионов слабых кислот, поэтому общая щелочность обычно численно совпадает с концентрацией бикарбонатов, выраженной в единицах мг-экв/кг.
Так как аналитически достаточно надежно определенным значением щелочности можно считать 10-5 н. (0,01 мг-экв/кг), учет гидратной щелочности следует проводить лишь при концентрации ионов ОН- > 10-5 н., т. е. при рН > 9.
Экспериментально щелочность определяют титрованием пробы воды кислотой в присутствии кислотно-щелочных индикаторов, меняющих свою окраску при различных значениях рН. Как видно из табл. 3, в случае использования индикаторов, меняющих свою окраску при рН » 8,2 (фенолфталеин) и рН»4,4 (метиловый оранжевый), при титровании легко идентифицировать бикарбонатную гидратную и карбонатную щелочность. Обозначая через Ф количество израсходованной кислоты при титровании по фенолфталеину и через М суммарный расход кислоты по фенолфталеину и метиловому оранжевому с учетом мольных переходов СО32- → НСО3- → Н2СО3, получаем данные для определения вида щелочности Щ0г Щк, Щг (таблица 7).
Жесткость воды — один из важнейших показателей ее качества. Общей жесткостью (ЖО) называют суммарную концентрацию ионов кальция и магния, выраженную в эквивалентных единицах (мг-экв/кг, а при очень малых значениях — в мкг-экв/кг). Общую жесткость воды подразделяют на кальциевую и магниевую. Часть ЖО (в предельном случае при ЩО> ЖО вся жесткость), эквивалентная содержанию бикарбонатов, называется карбонатной жесткостью, разность между общей и карбонатной жесткостями называется некарбонатной жесткостью.
Процесс выделения из воды ионов Са2+ и Mg2+ получил название умягчения воды. Воды с высокой жесткостью, дают плотные отложения на теплопередающих поверхностях.
По значению общей жесткости природных вод установлена следующая классификация: ЖО < 1,5 мг-экв/кг — малая жесткость, ЖО =1,5- 3,0 мг-экв/кг — средняя, ЖО = 3,0 - 6,0 мг-экв/кг— повышенная, ЖО = 6,0 - 12,0 мг-экв/кг— высокая, Жо > 12 мг-экв/кг — очень высокая жесткость.
Окисляемость воды — это показатель, имеющий условное значение и представляющий собой расход какого-либо сильного окислителя, необходимого для окисления в определенных условиях органических примесей, которые содержатся в 1 л воды. Обычно для этих целей применяют перманганат калия (КМnО4) или бихромат калия (К2Сг2О7), различая соответственно перманганатную и бихроматную окисляемость. Результаты определения перманганатной окисляемости воды выражают в кислородных или перманганатных единицах (О2, КМnО4, мг/кг), различающихся в 3,95 раза. Бихроматная окисляемость обычно превышает в 2— 2,5 раза перманганатную, а разность между ними позволяет судить об устойчивости органических примесей к действию окислителей. При определении окисляемости обоих видов происходит окисление не только содержащихся в воде органических веществ, но и некоторых неорганических, например закисного железа, сероводорода, нитритов. Поэтому следует еще раз подчеркнуть, что окисляемость характеризует содержание в воде органических веществ лишь приближенно и условно.
Окисляемость чистых грунтовых вод составляет обычно 1—3 мг О2/кг, в то время как в водах поверхностных источников окисляемость повышается до 10—12 мг О2/кг. Реки болотного происхождения и поверхностные источники, в период паводка отличаются очень высокой окисляемостью, превышающей, например, 30 мг О2/кг. Сточные воды, содержащие органические вещества и сбрасываемые в водоемы, могут повышать окисляемость воды различных источников.
Для суммарной оценки органических загрязнений воды в последнее время начинают применять метод сорбции из воды органических веществ активированным углем с последующим его высушиванием и экстракцией из него этих веществ хлороформом (метод угольно-хлороформного экстракта). В массовых единицах (мг/кг) оценивают в ряде случаев содержание общего органического углерода в воде.
Концентрация растворенных газов в воде зависит от их природы, температуры воды и парциального давления, типа и концентрации минеральных и органических примесей воды, рН воды и т. п.
Дата добавления: 2016-05-31; просмотров: 2013;











