Становление и развитие структурной химии, современные её проблемы
Самые первые структурные представления возникали в атомистике Д. Дальтона в качестве своеобразного вывода из учения о составе и функционируют на первом уровне развития химических знаний, т. е. в русле первой концептуальной системы.
Дальтон, развивая представления о способах объединения «простых атомов» в «сложные», преследовал лишь одну цель - создать теорию для объяснения эмпирически открытых стехиометрических законов. Иначе говоря, Дальтон решал проблему отношений только между составом и структурой тел, опираясь на результаты предшествующего изучения отношений между составом и свойствами и вовсе не затрагивая проблемы изменения свойств в зависимости от структуры.
Вслед за Дальтоном, который обратился к понятию структуры для того, чтобы подвести теоретический, фундамент под эмпирические законы, регулирующие состав соединений, к тому же понятию прибегнул Берцелиус, впервые со всей определенностью указавший на недостаточность фактора состава для объяснения свойств и бесконечного качественного разнообразия химических соединений. Правда, предлагая такое принципиально новое объяснение, Берцелиус не только не назвал его структурным, но он даже не применил в нем термина «структура». И тем не менее все вопросы, которые пришлось ему решать, относятся к фундаментальным вопросам структурной химии. Сюда прежде всего относятся суждения о природе сродства и химической связи атомов в частице.
Сущность учения Берцелиуса о химических соединениях сводится к следующим положениям:
1. все химические элементы можно расположить в ряд, где в направлении справа налево каждый последующий элемент будет являться более электроотрицательным, чем предыдущий, и. наоборот, в направлении слева направо каждый последующий элемент будет более электроположительным;
2. атом каждого элемента несет оба заряда, но в зависимости от места элемента в ряду один из зарядов больше;
3. образование химических соединений происходит за счет частичной нейтрализации зарядов, так как полная их компенсация вследствие неравенства зарядов атомов невозможна;
4. из предыдущего положения следует, что частица (молекула) каждого соединения также обладает каким-либо избыточным зарядом.
Таким образом, Берцелиус считал, что частица (молекула) химического соединения представляет собой не хаотическое нагромождение атомов, а определенную упорядоченность, заключающуюся в объединении двух разноименно заряженных атомов или атомных группировок, способных к самостоятельному существованию. Теория Берцелиуса, получившая в связи с этим название дуалистической теории, уже в 1815—1825 гг. была распространена на органические соединения, особенности которых объяснялись наличием в них сложных радикалов. Подтверждением дуалистической теории и одновременно мощным стимулом се развития явилось экспериментальное открытие сложных радикалов в составе органических молекул. Поиск органических радикалов, направляемый дуалистической теорией, стал модой.
Концепцией, положившей конец дуализму, оказалась унитарная теория Ш. Жерара, отчетливо сформулированная и экспериментально обоснованная им в ряде работ в 1840-х годах. Сущность этой теории можно свести к следующим положениям.
1. Вновь образованное химическое соединение следует рассматривать не только как качественно новое вещество, но и как утрату прежних свойств составивших его химических элементов.
2. Молекула химического соединения представляет собой не простую совокупность атомов и атомных групп, способных к самостоятельному существованию, а целостную «унитарную», или единую систему.
3. Отличие молекулы как унитарной системы от множества самостоятельно существующих элементов, из которых она образована, состоит в том, что в системе атомы вступают во взаимодействие, приводящее к существенным изменениям их свойств.
4. Для более точного описания качественного состояния вещества целесообразно ввести, помимо понятия свойств тела и свойств молекулы, новое понятие функции, посредством которого можно характеризовать химическую способность атомов и атомных групп в молекуле.
5. Функция любого данного атома в молекуле зависит не только от природы элемента, но и от его количества, равно и от природы и количества тех элементов, с которыми он соединен. Например, элемент, который обыкновенно бывает металлом, в другом соединении может вести себя как неметалл.
Унитарная теория была органически связана с выдающимися результатами работ Жерара. С унитарной теорией тесно связан также призыв Жерара осмотрительнее относиться к так называемым «рациональным» формулам, раскрывающим структуру соединений, не абсолютизировать их. Жерар считал, что эти формулы - лишь относительно истинные выражения, которые резюмируют более или менее полно некоторое число превращений. Он активно выступал за то, чтобы одно химическое соединение могло характеризоваться посредством нескольких «рациональных» формул (т. е. развернутых формульных схем), - каждая из которых полнее передавала бы особенности химических функций молекулы. Это можно рассматривать как пролог к теории резонанса Л. Полинга.
Дальнейшее продолжение развития структурной химии связано с другим талантливым химиком А. Кекуле и выдвижения им в 1858 г. такой структурной теории, которая позволяла «из природы элементов выводить природу как радикалов, так и их соединений». Сущность этой теории сводилась к следующему:
1. Атом каждого элемента характеризуется определенной способностью вступать в химическое взаимодействие с другими элементами в строгом соответствии с его «атомностью» (т. е. валентностью), выражаемой числом единиц сродства.
2. Все элементы распределяются на одновалентны, двухвалентные, трехвалентные и четырехвалентные.
3. Исходя из этого, как радикалы, так и химические соединения можно рассматривать как объединение атомов путем такого их «соприлегания» друг к другу, при котором каждая из единиц сродства одного атома вступает в соединение с единицей сродства другого.
Одновременно с теорией Кекуле в 1858 г. появилось сообщение Купера «О новой химической теории», в котором на основании тех же предпосылок и представлений о возможности образования углерод-углеродных цепей были предложены первые структурные формулы пропилового и бутилового спиртов, гликоля, глицерина, щавелевой кислоты. Теории Кекуле и Купера с необыкновенной легкостью и простотой объясняли строение и «сложных радикалов», и органических соединений в целом. Молекула любого химического соединения рассматривалась в этих теориях как такое целостное образование (дань унитарному учению Жерара), которое складывается из атомов за счет полного взаимного насыщения единиц сродства. Теории Кекуле и Купера обосновали таким образом истинность и действенность учения Берцелиуса о сложных радикалах, но они запретили то вольное обращение с понятием радикала, которое допускал Берцелиус, стирая грань между радикалом и молекулой. Но теоретический фундамент, подведенный под структурную органическую химию Кекуле и Купером, был ещё очень непрочным. Его простота и наглядность были обусловлены нарочито упрощенным – аддитивным -подходом к изучению молекулы. Но обвинять в этом Кекуле не следует, так как он поднял структурную химию одной ступенью выше, и она, эта ступень, стала рабочей платформой для строительства первенцев промышленности органической химии.
Теория химического строения А. М. Бутлерова - первая теория реакционной способности органических веществ. В 1861 г., А. М. Бутлеров показал, что в основу структурных представлений должны быть положены не столько суммативные геометрические принципы, сколько системные химические представления, определяющие реакционную способность любого структурного фрагмента молекулы в зависимости от всей структуры в целом. Бутлеров действительно явился первым представителем классической химии, решительно вступившим на путь отказа от абсолютизации стехио-метрических, или «основных», законов химии, согласно которым атомной дискретности якобы непременно должна соответствовать и дискретность химизма. Когда мы говорим о теории химического строения в связи с главной ее эмпирической опорой - объяснением многочисленных случаев изомерии, то нам, естественно, приходится больше обращать внимания на то ее положение, которое относится к порядку распределения связей между отдельными атомами, к способу взаимного соединения атомов. Этот способ для одного и того же числа одних и тех же атомов может быть разным. Но бутлеровская теория химического строения включает в себя не одно только положение о способах взаимного соединения атомов. Это положение можно считать логическим выводом из теории валетности Кекуле и теории образования углерод-углеродных цепей Купера. Принципиальной отличительной чертой теории А. М. Бутлерова является именно положение о «распределении действия» химической силы (сродства), «вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу» и образуют неравноценные межатомные связи. Выдвигая это положение, Бутлеров, переступает порог стехиометрии. Не имея еще ясных физических представлений о возможности сочетания понятий о целочисленной характеристике свойств химической связи, он указывает, однако, на то, что от «количества сродства необходимо отличать его напряжение, — большую или меньшую энергию, с которой оно связывает вещества между собой». Он говорит далее, что «напряжение это изменяется, смотря по натуре действующих веществ и по условиям, при которых действие происходит».
Сегодня мы отчетливо представляем себе, что элемент водород остается водородом при переходе из одного соединения в другое, но как разительно изменяются при этом его признаки. А. М. Бутлеров не только отметил это, хотя и на других примерах, но и установил причины явления. Сегодня мы ясно осознаем, что реакционная способность отдельных фрагментов структуры молекулы, например С—Н - связи, зависит от энергии связи.
Теорияхимического строения Бутлерова потому именно и стала действенным орудием органического синтеза, что она ввела в понятие структуры самое важное для практического преобразования вещества: представление о «порядке связей» в молекулах, в сущности, об их энергетической характеристике, которая выражалась тогда посредством рядов относительной прочности связей. Так, например, школой Бутлерова было установлено прочность связи С-Н. Теория химического строения открыла путь к познанию химических функций (или реакционной способности) отдельных структурных фрагментов молекулы. Она могла предсказать и объяснить существенно различную реакционную способность отдельных атомов, отдельных связей и т. д. в различных молекулах.
Это означает, что теория химического строения выяснила генезис химических свойств вещества как макротела, посредством изучения взаимного влияния атомов в молекуле и выяснения реакционной способности отдельных ее структурных фрагментов. Понятие свойств расчленялось, таким образом, на два понятия: химических свойств макротела и реакционной способности и отдельных структурных элементов, и всей молекулы в целом, и вещества как совокупности молекул. Бутлеровская теория и называется теорией химического строения потому, что она выдвинула на первый план представления о химической связи и о «химической энергии» за счет которой происходит объединение атомов в молекулу, оставив «покамест» в стороне вопрос о сорасположении атомов. Но уже в середине 1870-х годов появилась необходимость учесть и фактор сорасположения, так как были открыты оптические и геометрические изомеры органических соединений, различие в свойствах которых оказалось возможным объяснить лишь на основе различия пространственного строения молекул. С этой целью в 1874 г. Я. Г. Вант-Гофф и Ж. Ле Бель порознь выдвинули ряд теоретических положений, составивших единую стройную концепцию, названную стереохимией.
Стереохимия - это синтез представлений о химическом строении и пространственном сорасположении атомов в молекулах. И поскольку такой синтез обогатил понятие структуры молекул новым содержанием, включив в него представления о формировании свойств вещества под влиянием таких стереохимических факторов, как зеркальная изомерия, цис-транс-расположение, эффекты свободного и заторможенного вращения вокруг С—С-связи и т. д., появление стереохимии означало подъем всей структурной химии органических соединений на новый уровень.
Стереохимия не является каким бы то ни было отрицанием бутлеровской теории. Стереохимия как новая теория не заменяет и не сменяет теорию химического строения, а лишь дополняет ее.
Дальнейшее развитие понятия структура связана с появлением электронных теорий химии. Хотя и весьма условно, но в химии принято считать классическим период до появления этих представлений. Однако проникновение в химию первых электронных представлений скорее следовало бы считать завершением классической химии, чем началом неклассического периода. Электронные представления, вызванные открытием электрона и выдвижением гипотезы о строении атома, принесли в химию новые идеи о химическом строении и структуры в целом.
С одной стороны, они указали на то, что ответственными за образование химической связи являются внешние валентные электроны атомов. Таким образом, классическая валентность была истолкована как электровалентность, а химическая связь — как такое перераспределение валентных электронов между взаимодействующими атомами, которое обеспечивает последним устойчивый октет внешней электронной оболочки. Этот вывод имел исключительно важное значение, так как он впервые за всю историю химии открывал путь к познанию глубокой внутренней сути химизма.
С другой стороны, первые электронные представления оказались шагом назад по сравнению с феноменологическими структурными теориями. Если последние описывали химическую связь как взаимодействие, имеющее широкую энергетическую неоднородность, и этим освещали путь практического синтеза веществ, то первые электронные теории возвращали химиков назад к Кекуле. Валентный штрих простой связи они интерпретировали как образование локализованной пары дискретных электронов. А это означало подтверждение идей о целочисленных значениях сродства и сил связи. Правда, этот шаг назад не оказал существенного влияния на судьбы структурной химии. Идеи о различной энергоемкости связей одержали верх. Уже с конца 1920-х годов появились такие электронные теории, которые служили преддверием квантовой химии и которые вкладывали в понятие структуры молекулы и электронное содержание, и энергетическую неэквивалентность связей. Это были теории электронных смещений, мезомерии, электронной таутомерии, резонанса.
В 1926-1927 гг. появились работы в области квантовой химии. Основные положения этих работ, затрагивающие понятие структуры в химии следующие:
1. Любая химическая частица как агрегат химически взаимодействующих атомов рассматривается как единая квантово-механическая система, образование и существование которой обусловлено понижением энергии при переходе от атомов к соединению. Критерием устойчивости этой системы является минимум ее полной энергии как функции межатомных расстояний.
2. Сущность химического взаимодействия между атомами, согласно квантовой теории, сводится к взаимодействию между валентными электронами (которые, переходя с атомных орбит на общемолекулярные, создают единый электронный заряд) и положительно заряженными ядрами.
3. Ввиду того, что в химической частице все валентные электроны коллективизированы, принадлежат всем ядрам и осуществляется всеобщее взаимодействие всех ядер со всеми электронами, химические связи в принципе скорее следует представлять как многоцентровые, нежели попарные. Однако во многих случаях на попарных связях локализуется несравненно большая электронная плотность и их истолковывают как «сильные связи», взаимное же влияние всех других ядер принимают за «слабое взаимодействие».
4. В зависимости от состава химическое взаимодействие в частицах осуществляется по-разному. Существует ковалентная химическая связь, ионная связь, металлическая связь и т. д.
Корни противопоставления понятий структуры и динамики уходят в далекое прошлое. В естествознании понятие структуры по крайней мере уже с XVII в. применяется для обозначения взаимного расположения составных частей природных или искусственно полученных сложных тел. Понятие структуры прочно вошло в кристаллографию как синоним жесткого пространственного сорасположения атомов в твердых телах, обладающих формой многогранника. Именно из кристаллографии это понятие непосредственно перешло в химию. В классической химии не было серьезных поводов отступать от той трактовки понятия структуры, которая сложилась под влиянием кристаллографии. Практика органического синтеза неизменно подтверждала истинность наглядных представлений об относительно стабильных, т. е. не изменяющихся, не перемещающихся химических связях между атомами в молекулах тех химических соединений, которые не претерпевают качественных превращений.
С течением времени химики все больше склонялись к мысли, что химическую связь в молекуле нельзя рассматривать как совершенно жесткое прикрепление атомов друг к другу, и именно поэтому некоторые из них выступали против использования понятия структуры или строения. Проблема внутренней динамики молекул возникла, в частности, в связи с обсуждением бутлеровской теории химического строения. Эта теория встретила резкие возражения со стороны Н. А. Меншуткина, который считал, что молекула не может быть вообще охарактеризована посредством понятия структуры, так как составляющие ее атомы находятся в состоянии непрерывного движения. При этом под структурой или строением Меншуткин понимал лишь статику сооружения молекулы, а под динамикой -механическое перемещение атомов. Бутлеров же сущность внутренней динамики молекулы видел в «определенной взаимной зависимости между атомами», которая выражается в определенном порядке связей между ними, в неодинаковом распределении сил, или энергии, сродства по этим связям. При этом под структурой или строением Меншуткин понимал лишь статику сооружения молекулы, а под динамикой - механическое перемещение атомов. Бутлеров же сущность внутренней динамики молекулы видел в «определенной взаимной зависимости между атомами», которая выражается в определенном порядке связей между ними, в неодинаковом распределении сил, или энергии, сродства по этим связям.Отвечая Н. А. Меншуткину, он писал, что химическое соединение не есть «что-либо мертвое, неподвижное ... напротив оно одарено постоянным движением, заключенным в его самых мельчайших частичках». Бутлеров стремился показать, таким образом, что понятие структуры не отвергает динамических представлений. Однако бутлеровское положение о совместимости структурных и динамических характеристик молекулы в XIX в. еще не могло найти экспериментального подтверждения. О том, что химическое соединение «одарено постоянным движением, заключенным в его самых мельчайших частичках», никто не мог сказать ничего конкретного.
Ясность в представления о внутренней динамике молекул была внесена лишь в первой половине XX в. в результате появления многочисленных методов физического исследования веществ. Был установлен механизм линейных и вращательных внутримолекулярных колебаний атомов и атомных групп, выяснился характер возбужденного состояния молекул и заключения о распределении электронной плотности в молекулах, а также появилась определенная информацию о динамических аспектах молекул.
За последнее время появляется все больше информации о перемещении атомов и атомных групп внутри химических частиц без изменения качественного состояния химического соединения. В 1960-е годы методами изотопного анализа установлено обменное перемещение водородных атомов во многих углеводородах.
Наступает пора коренным образом пересмотреть те чересчур резкие барьеры, которые мы сами возвели для отграничения соединений от процессов. Конечно, предметы и процессы, так же как статика и динамика, - это противоположности. Но противоположности немыслимы без единства. Химия же давно показала, что в реальных условиях все химические соединения так или иначе подвергаются изменениям, оставаясь при этом вне реакции лишь условно. Значит, в массе вещества при температуре выше абсолютного нуля любое химическое соединение, даже длительно сохраняющееся «без изменений», в сущности представляет собой своеобразную кинетическую систему. Вспомним, что говорил по этому поводу Д. И. Менделеев: «...в массе частиц должно, или, по крайней мере, может происходить обменное движение атомов. Если даны частицы АВ и АВ, то А из первой может переходить во вторую частицу и обратно. Акт замещения, столь общий для массы химических превращений... оттого, быть может, и свойственен всяким частицам, даже сложнейшим, что в состоянии химической неизменяемости (т. е., условно вне реакции) уже существует обмен между однородными атомами однородных частиц...».
Появляются множество работ, идущих в данном направлении и, прежде всего, это работы Ю. А. Жданова.Важнейшиенаучные работы Ю. А. Жданова посвящены органической химии и философским проблемам естествознания. В 1960-е годы им были разработаны новые методы синтеза C-гликозидов некоторых сахаров. Осуществил синтез пирилиевых солей, сконденсированных с фурановым и тиофеновым циклами. Но главное достижение – это открытие принципиально нового типа таутомерии - ацилотропная таутомерия, который стал удобным способом подхода к изучению ряда сложных биохимических процессов. Эта новая разновидность таутомерии, суть которой состоит в быстрой обратимой миграции ацильных групп между нуклеофильными центрами в молекулах органических соединений. Это показало, что существование многих таутомерных систем, которые интерпретировались в классической химии как сосуществование переходящих друг в друга, но качественно отличных друг от друга молекул изомеров, ныне «можно описать как процессы миграции определенной атомной группы между двумя или несколькими атомными центрами в молекуле» в одной качественно неизменной молекуле.
Также получены учеными и другие результаты, приводящие к тем же выводам, а именно, показано, что при обычной температуре практически все оксиды металлов (ZnO, АI2О3, Си2О т. д.) обменивают атомы своего кислорода на атомы кислорода воздуха, воды, спирта и других веществ при соприкосновении с ними. Есть указания на то, что даже в таких прочных соединениях, которые представлены решетками корунда и алмаза, атомы углерода из первых пяти - семи атомных слоев обмениваются с атомами углерода из любых углеродсодержащих веществ.
Другим отражением современной структурной химии является явление, сходное с резонансом и электронной таутомерией, хотя и не идентичное им, и обнаружено в последнее время экспериментально.
«Быстрая обратимая валентная изомеризация» в рядах бульвалена, циклооктатетраена, би- и трициклических гомотропилиденовых систем и вообще циклических систем полиенового типа. Для этого нового типа изомеризации характерно, что она сопровождается соответствующими изменениями в относительном расположении s- и p-связей и лишь небольшими изменениями в межатомных расстояниях и валентных углах. Установлено, что молекула синтезированного в 1963 г. бульвалена С10Н10 существует в виде резонансного гибрида 1,2 млн. валентных изомеров, разделенных энергетическим барьером в 49,40 кДж/моль. Она представляет собой, таким образом, и предмет - качественно неизменное вещество - и процесс - непрерывно протекающую химическую реакцию. Так как эта обратимая изомеризация «связана только с перераспределением валентных связей, т. е. электронов, но не атомов», то её второе название - «электронная таутомерия».
Бульвален (англ. bulla – пузырь) – углеводород каркасного строения, имеющий состав С10Н10, т. плавл. 96° С, легко возгоняется, термически устойчив, одно из самых необычных соединений органической химии. Его свойства были предсказаны в докладе на Бутлеровском конгрессе в 1961, два года спустя соединение было получено Г.Шредером.
При получении бульвалена исходным соединением служит циклический углеводород с четырьмя двойными связями (циклооктатетраен С8Н8). При кипячении этого соединения две циклические молекулы соединяются, образуя димер, имеющий полициклическое строение:
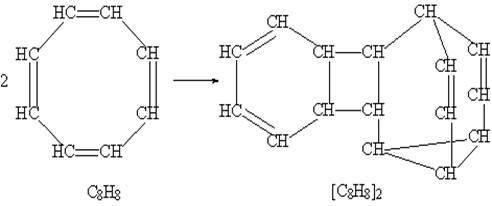
В полученном соединении наиболее напряженная часть – цикл из четырех атомов углерода. При облучении ультафиолетовым светом этого димера две простые связи четырехчленного циклического фрагмента размыкаются и затем замыкаются вновь с образованием новых связей, в результате образуется бензол и бульвален (размыкающиеся связи отмечены красным цветом, а вновь образованные – зеленым):
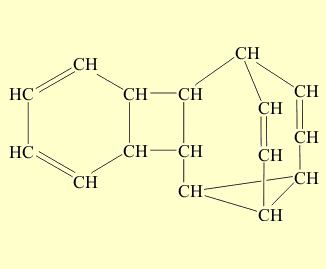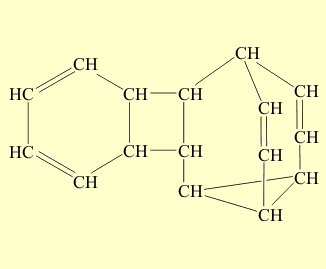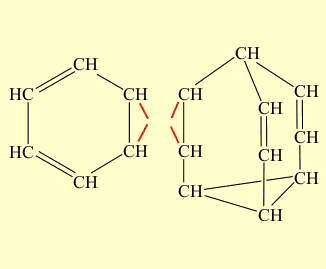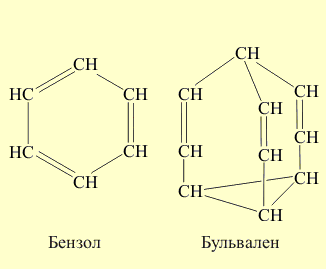
При облучении ультрафиолетовым светом димера две простые связи четырехчленного циклического фрагмента размыкаются и затем замыкаются вновь с образованием новых связей, в результате образуется бензол и бульвален (размыкающиеся связи отмечены красным цветом, а вновь образованные – зеленым)
В основании молекулы бульвалена расположен треугольник из трех атомов углерода (фрагмент циклопропана), от каждой вершины треугольника отходит углеводородная ветвь, содержащая кратную связь, все три ветви сходятся в одной точке. Ниже на рисунке показан углеродный каркас молекулы в виде стереопары (атомы, приближающиеся к наблюдателю,
окрашиваются в более темный свет):
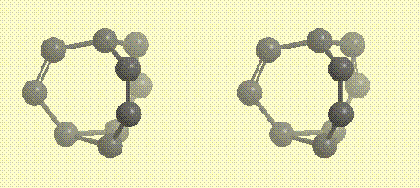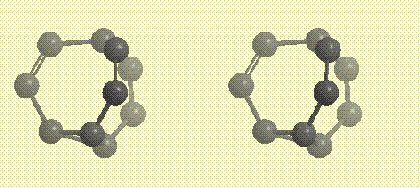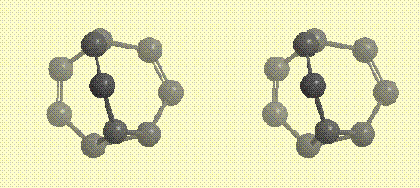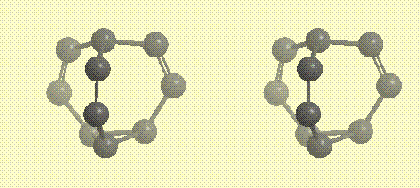
Углеродный каркас молекулы бульвалена в виде стереопары (атомы, приближающиеся к наблюдателю, окрашиваются в более темный цвет)
Свойства бульвалена, предсказанные Дерингом подтвердились. Одна из простых связей циклопропанового кольца размыкается, при этом дополнительно раскрываются две двойные связи, те, что расположены ближе к разомкнувшейся простой связи. В результате образуются три новых связей - простая и две двойных, но расположенных в ином месте каркаса. На рисунке, показанном ниже, размыкающиеся связи выделены красным цветом, а вновь возникшие - синим. Процесс несколько напоминает показанное ранее перестраивание связей, происходящее при синтезе бульвалена:
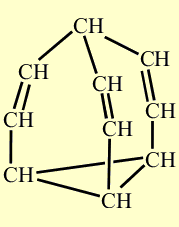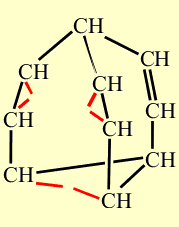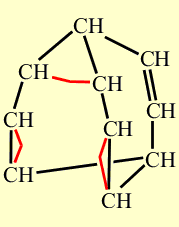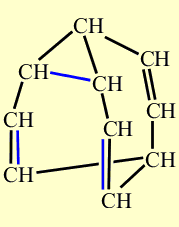
Образование трех новых связей. Размыкающиеся связи выделены красным цветом, а вновь возникшие – синим.
Строение полученного соединения полностью воспроизводит исходное соединение, в чем можно убедиться, если несколько деформировать полученную молекулу, не разрывая при этом никакие связи:
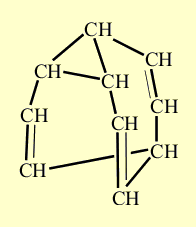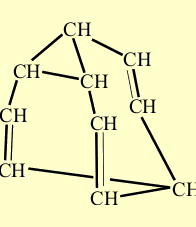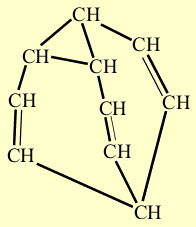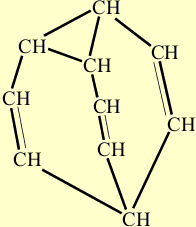
Образование трех новых связей. Размыкающиеся связи выделены красным цветом, а вновь возникшие – синим.
Получившееся соединение, так же, как и исходное, содержит треугольник из атомов углерода, от вершин которого отходят три ветви с двойными связями, сходящиеся в одной точке. Изменилась лишь «роль» некоторых атомов углерода, треугольник возник в новом месте каркаса, а две двойные связи образовались между иными парами углеродных атомов.
Образовавшееся соединение может далее перегруппировываться по той же схеме. На рисунке, показанном ниже, представлено несколько результатов такой перегруппировки. Над стрелками указано, между какими атомами углерода циклопропанового кольца связь разомкнулась, а под стрелкой – где возникла новая простая связь (двойные связи при этом меняют свое положение):

Все показанные структуры полностью идентичны исходной, в чем можно убедится, деформируя их каркасы, как было показано ранее. «Роль» углеродных атомов в каркасе постоянно меняется, например, атом 10 поочередно входит в состав треугольника, двойной связи, он же в определенный момент становится вершиной, где сходятся три ветви. В результате, треугольник и двойные связи постоянно перемещаются по каркасу. Расчет показывает, что для бульвалена возможно более миллиона таких состояний, быстро переходящих друг в друга, что внешне напоминает своеобразную комбинаторную игрушку.
Исследования бульвалена существенно расширили существующие представления о процессах перегруппировки органических соединений.
Антиномия понятий структуры и динамики, существовавшая во все времена истории структурной химии, начиная с Берцелиуса и до 60-х годов текущего столетия, таким образом, полностью исключается в ходе приближения химических знаний к наиболее глубоким слоям сущности внутреннего строения молекул. Это открывает новые возможности прогнозирования реакционной способности веществ с целью управления химическим процессом. Вместе с тем на этой ступени эволюции понятия структуры становятся ясными не только дальнейшие, по существу безграничные перспективы развития структурной химии, но и пределы ее использования, т. е. необходимость подъема химических знаний на уровень третьей концептуальной системы — учения о химическом процессе.
| <== предыдущая лекция | | | следующая лекция ==> |
| Колебательные реакции | | | Основы конструирования зданий. Факторы, влияющие на выбор конструктивной схемы. |
Дата добавления: 2016-05-30; просмотров: 3584;











