А. Судзуки Э. Нагиси Р. Хек
Акира Судзуки родился 12 сентября 1930 г. в городке Мукава, расположенный на японском острове Хоккайдо. Окончил университет Хоккайдо в Саппоро. В 1994 г. Судзуки уходит из университета Хоккайдо и 1 год работает Окаямском университете наук. А с 1995 по 2002 гг. работает в Университете наук и искусства Курашики. В 1979 г. опубликовал первые сведения о органическая реакции арил- винилбороновых кислот с арил- или винил-галогенидами, катализируемая комплексами Pd(0). Во многих современных публикациях этот процесс называют также «реакцией Судзуки-Мияуры», или «сочетанием Судзуки». Реакция Судзуки широко используется в препаративной органической химий для получения полиолефинов, стиролов, а также замещенных бифенилов.
Эйити Нагиси родился 14 июля 1935 года в городе Чанчунь. Степень бакалавра получил в 1958 году в Токийском университете. Потом начал работать в химической компании "Teijin". В 1960 г. поступил в Пенсильванский университет, где в 1963 г. получил степень доктора философии. После этого вернулся в компанию "Teijin". В 1960 поступил в Пенсильванский университет, где в 1963 г. получил степень доктора философии. В 1966 г. начал работать в лаборатории Герберта Чарлза Брауна в Университете Пердью. в 1968 г. получил должность ассистента профессора Брауна. С 1972 по 1979 гг. работал Сиракузском университете, но потом вернулся в Пердью.
Ричард Хек (Richard F. Heck) родился 15 августа 1931 г. в Спрингфилде (штат Массачусетс). В 1952 г. получил степень бакалавра в Калифорнийском университете, через 2 года там же получил степень доктора философии. Потом переехал в Швейцарию, где работал в высшей технической школе Цюриха. После этого вернулся в Лос-Анджелес, и некоторое время работал в Калифорнийском университете, пока в 1957 г. компания "Hercules" не предложила ему работу. С 1971 по 1989 гг. работал в университете Делавэра.
В каталитических реакциях участвует «третье вещество» - катализатор, который не входит в состав исходных реагентов, не входит в состав продуктов реакции и в реакциях не расходуется, однако оказывает большое влияние на ее протекание. Первые катализаторы лишь ускоряли реакцию, снижая ее энергию активации (энергетический барьер, который нужно преодолеть, чтобы запустить химический процесс).
Однако катализатор во многих случаях способен не только ускорить реакцию, но и изменить ее путь, повысить ее селективность и, в конечном счете, привести к совсем другим продуктам взаимодействия.
В случае органических реакций повышение селективности и необходимая для этого активация атома углерода особенно важны. При взаимодействии крупных органических молекул в каждом исходном соединении есть несколько активных центров (атомов углерода), по которым может происходить связывание. В результате обычным для некаталитической органической реакции бывает получение смеси продуктов, среди которых целевой продукт необязательно составляет основную часть. Чем сложнее молекулы, тем больше продуктов. Поэтому чем сложнее синтез и целевая органическая молекула (лекарство или искусственное синтезированное природное соединение), тем острее стоит вопрос повышения селективности реакции и выхода целевого продукта.
Именно с этими задачами успешно справляются реакции катализируемого палладием кросс – сочетания. На самом деле катализатор, конечно, взаимодействует с реагентами: он участвует в образовании так называемого переходного состояния (отсюда изменение энергии активации) – комплекса, образующегося в реакционной смеси на пути от исходных веществ к продуктам реакции.
Собственно, все реакции сочетания подразделяются на две большие группы: кросс – сочетание (или перекрестное сочетание), при котором происходит конденсация (соединение) двух различных органических фрагментов, и гомосочетание, при котором соединяются одинаковые фрагменты из одного и того же исходного вещества. Более интересны для исследования и применения в синтетическом плане реакции кросс – сочетания, так как в этом случае получается большой спектр соединений за счет введения в реакцию различных фрагментов. При изучении реакций кросс – сочетания гомосочетание зачастую протекает как побочная, нежелательная реакция. Поэтому для увеличения селективности необходимо строго соблюдать условия синтеза: соотношение реагентов, концентрацию катализатора, тип растворителя, температуру.
Использование солей и комплексов металлов в качестве катализаторов перевернуло органическую химию и вывело «конструирование» крупных молекул из отдельных частей на совершенно иной уровень. В долгосрочном аспекте предшественником работ нынешних нобелевских лауреатов можно считать труды ставшего лауреатом почти 100 лет назад французского химика Виктора Гриньяра. Он создал ключевой для синтетической химии того времени реактив – класс магний – органических соединений, впервые позволивших сшивать органические соединения различной природы друг с другом. Новшество – создание металлоорганического соединения внедрением атома магния между атомами углерода и галогеном в галогенопроизводном. Такой реактив затем эффективно вступал в реакцию с различными соединениями (карбонилы, галогенопроизводные, тиолы, органические амины и цианиды), сшивая с ними исходный органический фрагмент. Это не только открыло перед химией совершенно новые возможности, но и породило новые проблемы – гриньяровские реакции зачастую не отличались высокой селективностью. Время диктовало новые требования.
В 70-е гг. XX в. Ричард Хек предложил свой вариант металлокомплексного катализа для сборки больших молекул из малых – взаимодействие алкенов с галогенопроизводными на палладиевом катализаторе.
Схема кросс – сочетания, разработанная Хеком, показана на рис.12. На первой стадии образуется промежуточное палладийорганическое соединение, схематично схожее с реактивом Гриньяра. Затем алкеновый атом углерода в бензольном кольце – это ключевая стадия образования новой углерод – углеродной связи. После этого и атом металла (обычно участвующий в реакции в виде комплекса), и галогенид (в данном случае бром) отщепляются от комплекса, и образуется конечный продукт реакции. В течение следующих 10 лет Нагиси и Судзуки совершенствовали методику реакций. Первый предложил ввести в нее модифицированный реактив Гриньяра (не магний, а цинкоорганику) – это повысило сродство атома углерода к атому палладия, а второй предложил заменить цинк на бор, что снизило токсичность веществ в реакционной смеси.
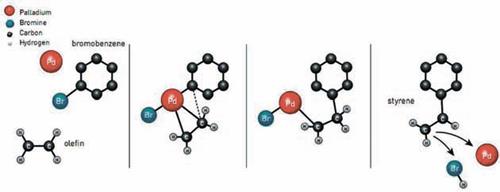
Рис.12. Схема реакции Хека
Палладиевые катализаторы и реакции кросс – сочетания используют для синтеза самых разных веществ различного назначения – новых материалов, лекарств, природных соединений. Важно то, что они позволяют конструировать большие молекулы из меньших вне зависимости от того, каково назначение исходных реагентов и продуктов.
Пластики, фармацевтические препараты, материалы для электронной промышленности и многое другое. Практически бесконечно разнообразные вещества, можно синтезировать при помощи метода, созданного Нагиси, Хеком и Судзуки.
Дата добавления: 2016-05-30; просмотров: 1743;











