А. Йонат В. Рамакришнан Т. Стейц
Ада Йонат родилась 22 июня 1939 года в Иерусалиме. Среднюю школу закончила в Тель-Авиве, затем была призвана в армию. В армии с отличием окончила офицерский курс. Демобилизовалась в звании лейтенанта медслужбы. Защитила 1-ую степень по химии (1962) и 2-ую степень по биофизике (1964) в Еврейском университете в Иерусалиме. Докторат (1969) Ада Йонат делала в Институте им. Вейцмана.
Венкатраман Рамакришнан родился в 1952 году в городке Чидамбарам на юге Индии. В 1971 г. получил степень бакалавра по физике в г. Валодар, после чего уехал в США, где в 1976 г. получил докторскую степень, также по физике, в Университете Огайо. Два года он учился биологии в Калифорнийском университете в Сан-Диего, затем работал в Йельском университете (где и начались его исследования рибосом), а в 1999 г. переехал в Англию, где возглавил исследовательскую группу в Лаборатории молекулярной биологии в Кембридже. С 2008 года является также сотрудником Тринити-колледжа Кембриджского университета.
Томас Стейц родился в 1940 г. в Милуоки (штат Висконсин). Он получил степень бакалавра по химии в Университете Лоуренса в Висконсине, а затем учился в Гарварде, где в 1966 году получил докторскую степень по биохимии и молекулярной биологии. С 1967-го по 1970 год он работал в Лаборатории молекулярной биологии Медицинского исследовательского совета в Кембридже, а с 1970 года работает в Йельском университете, где в настоящее время является профессором молекулярной биофизики и биохимии.
В конце 1970-х гг. Ада Йонат решила получить рентгенографическую структуру рибосомы. В то время большинство считало эту задачу неразрешимой, так как необходимо из рибосом сотворит кристалл.
В рентгеновской кристаллографии луч жесткого излучения направляют на исследуемый образец (например, высокоупорядоченное состояние белка - кристалл) и изучают возникающее при этом рассеяние, регистрируя дифракционную картину. Первоначально для регистрации использовалась светочувствительная пленка, отдельные участки которой под действием излучения затемнялись. Сейчас для этого используются ПЗС-матрицы (за которые, кстати, присудили Нобелевскую премию за 2009 г. по физике). Рентгеновское излучение получают в основном на синхротронах (ускорителях элементарных частиц). Когда лучи сталкиваются с кристаллом, они начинают рассеиваться, вырисовывая на детекторе картину дифракции, состоящую из миллионов отдельных точек (рефлексов). Анализируя дифракционную картину, можно определить точное распределение атомов в образце. Однако качественную картину может дать только практически идеальный кристалл, получение которого может быть затруднено, и чем больше белок, тем сложнее подобрать адекватные условия для кристаллизации.
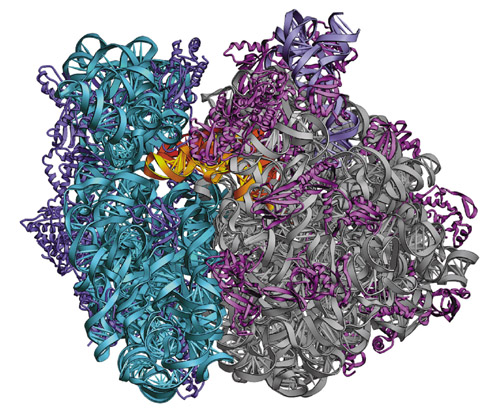
В силу перечисленных обстоятельств большинство отнеслось к начинаниям А. Йонат скептически. Рибосома (70S) – один из сложнейших существующих комплексов РНК/белок, состоящий из большой субъединицы (50 S) (одной большой молекулы РНК, «инкрустированной» примерно 32 белками) и малой субъединицы (30 S) (трех молекул РНК и около 36 белков). В сумме это составляет сотни тысяч атомов, и Йонат задалась целью определить положение каждого из них.
Когда А. Йонат решила закристаллизовать рибосому, ее выбор пал на бактерию, живущую в экстремальных условиях: Geobacillus stearothermophilus может обитать в источниках с температурой до 75 ºC. По предположениям Йонат, если уж рибосомы работают в таких жестких условиях, то и кристаллизацию они как-нибудь перенесут.
В 1980 г. были получены первые кристаллы, и это было действительно крупным достижением, несмотря на то, что их дифракционное качество было не высоким. После этого потребовалось еще 20 лет работы, чтобы определить структуру рибосомы, в которой было бы четко определено положение каждого атома. Йонат использовала много разных приемов, в частности замораживание при -196 ºС. В экспериментах участвовали и другие бактерии, например Haloarcula marismortui из чрезвычайно соленых вод Мертвого моря.
К началу 1990-х гг. кристаллы Йонат уже имели вполне удовлетворительное качество, чтобы по ним устанавливать положение каждого атома в структуре, однако оставалось еще затруднение, называемое у кристаллографов проблемой фаз. Чтобы по картине дифракции восстановить структуру, необходимо знать фазовый угол для каждого рефлекса на картине, а как найти эти фазы, было не понятно.
Часто для аналогичной задачи в кристалл добавляют тяжелые металлы вроде ртути и по различию дифракционных картин кристалла с металлом и без него вычисляют фазу. Однако в случае огромной рибосомы к образцу присоединялось сразу много атомов тяжелого металла, и вычислить фазы было сложно. Для решения проблемы требовалась дополнительная информация.
Решение проблемы предложил Томас Стейц, который использовал электронно-микроскопические изображения рибосомы, полученные Иоахимом Франком. Эти изображения помогли установить положение и примерную ориентацию рибосомы в кристалле, и, хотя не позволяли увидеть отдельные атомы, были использованы для восстановления набора фаз и получения рентгеновской структуры.
В 1998 г. Т. Стейц опубликовал первую структуру большой субъединицы рибосомы, на которой можно было различить положение молекул РНК и белков, но не больше: разрешение не превышало 9 Å. Но и это стало настоящим прорывом.
Основные проблемы были решены, и оставалось только улучшать качество кристаллов и накапливать статистику. К финишу лауреаты Нобелевской премии пришли практически одновременно: в августе и сентябре 2000 г. они опубликовали кристаллические структуры рибосомы с атомным разрешением: Стейц – большой субъединицы Haloarcula marismortui, а Йонат и Рамакришнан – малой субъединицы Thermus thermophilus.
Структура малой субъединицы, полученная Рамакришнаном, дает объяснение специфичности и точности синтеза белка рибосомой. Оказывается, в рибосомах есть что-то вроде молекулярной линейки, которая измеряет расстояние между кодоном мРНК и антикодоном тРНК. В случае, если это расстояние отличается от требуемого, тРНК немедленно диссоциирует. Двойная проверка – залог точности синтеза белка на рибосоме: не более одной ошибки на 100000 аминокислотных остатков.
Роль большой субъединицы рибосомы главным образом синтез белка: она катализирует образование пептидной связи между аминокислотами. Скорость работы рибосомы составляет примерно 20 синтезированных звеньев полипептидной цепи в минуту, и «поймать» рибосому на промежуточной стадии очень непросто.
Однако Т. Стейцу удалось сделать и это. Он проводил кристаллизацию большой субъединицы с аналогами аминокислот, и с помощью этих структур были найдены каталитические центры рибосомы и предложена схема процесса.
Дата добавления: 2016-05-30; просмотров: 1849;











