Химические свойства
Атом углерода в карбонильной группе находится в sp2-гибридизованном состоянии и связан с атомом кислорода двойной связью (одна σ-связь и одна π-связь). Эта связь по своей физической природе сходна с углерод-углеродной двойной связью в этилене, однако, в отличие от неё для карбонильной группы характерным является то, что π-электронное облако смещено к более электроотрицательному атому кислорода, вследствие чего связь становится сильно полярной. В то же время карбонильная группа характеризуется значительной поляризуемостью. Углеродный атом является электронодефицитным центром, а кислород – электроноизбыточным (рис. 16.1.)
Рисунок. 16.1. Строение карбонильной группы
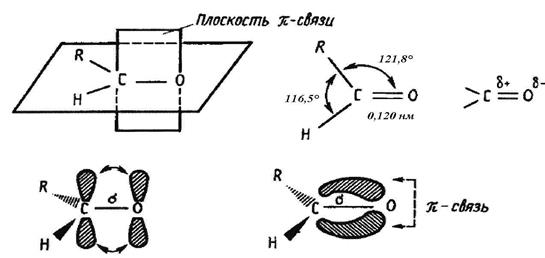
Плоскостное расположение атомов углерода и кислорода способствует тому, что карбонильная группа становится легко доступной для атаки.
Неподеленные пары электронов кислорода обусловливают слабые основные свойства карбонильной группы.
Учитывая все особенности строения карбонильной группы, а также соответствующие электронные эффекты, можно считать, что наибольший вклад в реакционную способность оксосоединений вносит карбонильная группа, а также связанные с α-углеродным атомом водородные атомы, что можно представить следующим образом:
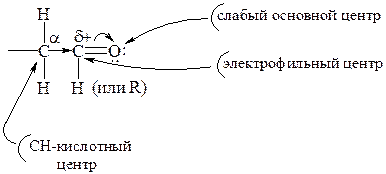
В случае альдегидов ряд превращений осуществляется при участии атома водорода, непосредственно связанного с карбонильной группой.
Сравнивая между собой альдегиды и кетоны по строению, можно предволожить, что более реакционноспособными являются альдегиды. Это, прежде всего, связано с тем, что в кетонах электрофильный центр, т.е. углерод карбонильной группы, пространственно больше затруднен и частичный положительный заряд на нем меньше из-за + I -эффекта двух углеводородных радикалов.
Если сравнивать реакционную способность, то образуется ряд:
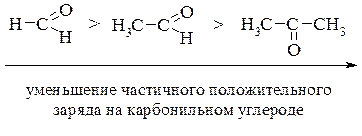
Дата добавления: 2020-10-01; просмотров: 612;











