Аллотропия химических элементов: Удивительные превращения формы и свойств веществ
Несмотря на то, что человеческое сознание достаточно быстро привыкает к трансформации свойств объекта при его соединении с другим, на начальном этапе изучения этот феномен вызывает искреннее удивление. Например, газообразный кислород, необходимый для дыхания, вступая в реакцию с другим газом — водородом, образует жидкую воду. В свою очередь, соединение того же кислорода с твердым телом — кремнием (силицием) — формирует твердый кварц, известный нам как кремень или песок.
Однако химический элемент способен кардинально менять свой облик и физико-химические характеристики даже без вступления в реакцию с иными веществами. Ярким примером служит все тот же кислород. Современная химия утверждает, что стандартная молекула кислорода состоит из двух атомов (O₂). Когда же три атома объединяются в одну молекулу (O₃), образуется принципиально иной газ — озон. Известно, что озон в значительных объемах генерируется при электрических разрядах; характерный запах, ощущаемый после удара молнии, часто ошибочно принимают за запах серы, хотя на деле это именно озон. От обычного кислорода озон отличается более высокой окислительной способностью, благодаря чему искусственно синтезированный озон применяется для отбеливания тканей и материалов.
Не менее примечательными аллотропическими свойствами обладает и такой элемент, как сера. В быту мы привыкли видеть ее либо в виде мелкого желтого порошка (так называемый серный цвет), либо в форме твердых желтых брусков (черенковая сера). Проведем эксперимент: расплавив значительную массу серы в термостойком сосуде и дав ей частично остыть до образования твердой корки на стенках и поверхности, следует проткнуть верхний слой и слить еще не застывшую жидкую серу.

Рисунок 1. Образование моноклинных кристаллов серы на стенках сосуда после слива незатвердевшей массы.
В результате на внутренних стенках емкости можно наблюдать множество удлиненных кристаллов игольчатой формы, обладающих эстетическим совершенством. Совершенно иную геометрию имеют природные кристаллы, добываемые в вулканических регионах. Для получения их искусственных аналогов серу растворяют в сероуглероде (работа требует строгого соблюдения пожарной безопасности из-за высокой летучести и огнеопасности растворителя), после чего дают жидкости испариться в хорошо вентилируемом помещении или на открытом воздухе, мирясь с неприятным запахом.
Наиболее экзотической формой является аморфная (пластическая) сера. Она синтезируется путем резкого охлаждения расплава серы в холодной воде. Полученная масса не становится хрупкой, а представляет собой эластичную, тягучую субстанцию коричневого цвета, которая, однако, метастабильна и в течение суток, как правило, возвращается к своей стабильной ромбической (кристаллической) модификации. Подобные метаморфозы демонстрирует и фосфор. В своей белой (желтой) модификации это воскообразное, легко режущееся ножом вещество крайне ядовито и пирофорно (самовоспламеняется на воздухе), что вынуждает хранить и обрабатывать его исключительно под слоем воды. Альтернативная форма — красный фосфор — нетоксична и обладает значительно меньшей химической активностью, возгораясь лишь при нагревании.
Такие вариации одного и того же химического элемента, существующего в двух или более формах, различающихся по строению и свойствам, именуются аллотропическими модификациями.
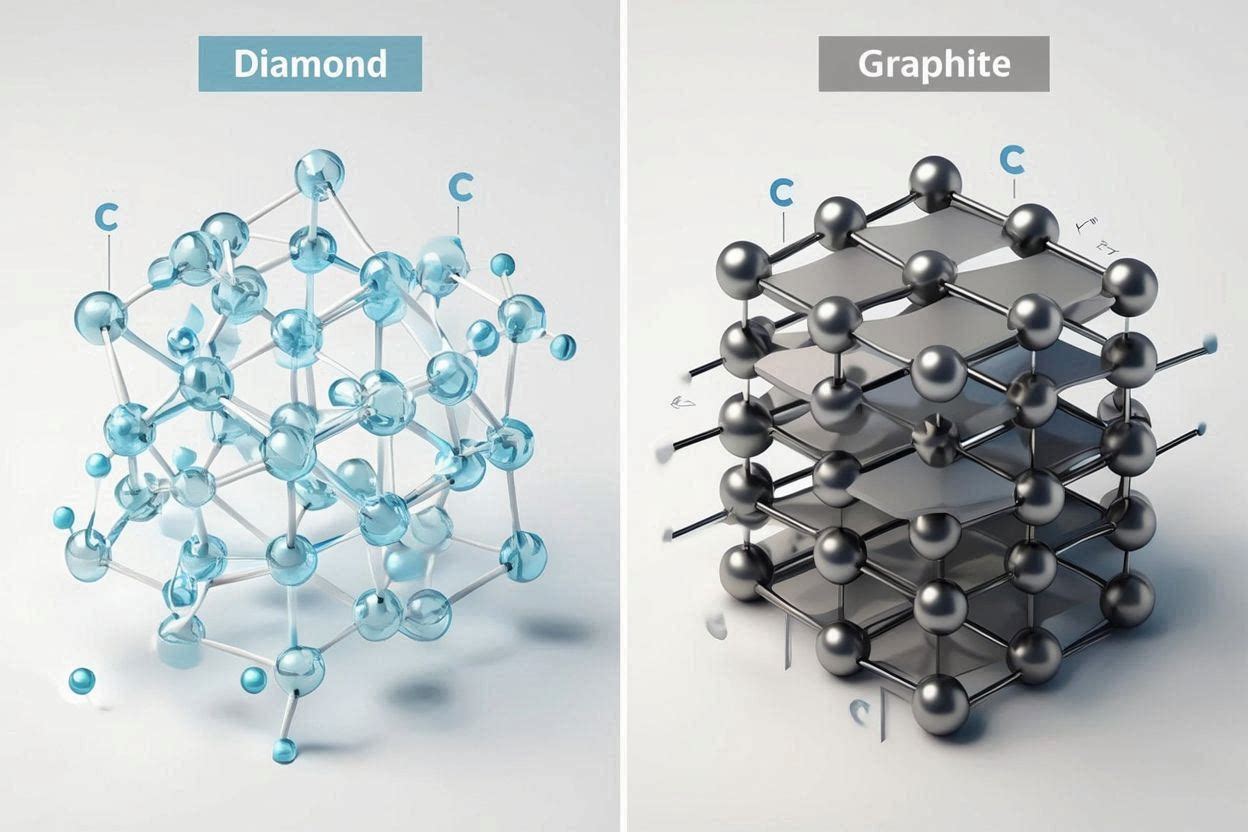
Рисунок 2. Кристаллические решетки алмаза и графита — ярчайший пример аллотропии углерода.
Наиболее выдающимся примером аллотропии в Периодической системе выступает углерод. Этот элемент известен в виде драгоценного алмаза, мягкого черно-серого графита и аморфного углерода (сажи). Доказательством того, что все эти три вещества суть один и тот же химический элемент, служит идентичность продукта их полного сгорания: во всех трех случаях образуется исключительно углекислый газ. Количественный анализ подтверждает это: равные массы алмаза, графита и сажи при сжигании производят строго одинаковые объемы CO₂. Однако энергетические характеристики процесса различны: аморфный углерод выделяет максимальное количество теплоты, тогда как алмаз демонстрирует минимальную теплотворную способность, что обусловлено различиями в энергии кристаллических решеток этих модификаций.
Сведения об авторах и источниках:
Авторы: В. Гампсон, К. Шеффер
Источник: Парадоксы природы
Данные публикации будут полезны студентам физических и технических специальностей, изучающих механику и принципы работы простых механизмов, начинающим инженерам и конструкторам, интересующимся эргономикой и оптимизацией транспортных средств, а также всем, кто увлекается историей техники и неочевидными физическими явлениями в повседневной жизни.
Дата добавления: 2026-02-16; просмотров: 51;











