Промышленные реакторы для крупномасштабных процессов с участием животных клеток
Все животные клетки по способности к росту в суспензии можно разделить на две группы. Так, клетки крови, лимфы, опухолевой ткани и многие трансформированные клетки могут расти в суспендированной культуре. Клетки других типов растут только в том случае, если они связаны с совместимой твердой поверхностью; в этом случае регуляторный механизм контактного ингибирования обычно останавливает клеточный рост, как только на поверхности твердого носителя образуется монослон клеток. В небольшом масштабе для перемешивания суспензионных культур достаточно магнитной мешалки и колбы или сосуда, частично заполненного средой, вращающегося в горизонтальном положении со скоростью около 1 об/мин.
По своей конструкции многие реакторы, предназначенные для культивирования больших количеств животных клеток, напоминают микробиологические биореакторы. Обычные для культур микроорганизмов турбинные мешалки с плоскими лопастями в случае культур животных клеток часто заменяют на пропеллерные. Предложена конструкция эффективного реактора с рабочим объемом около 100 л, в котором для перемешивания суспензионной культуры применяется не лопастная мешалка, а устройство с «парусами» из моноволокна. В отличие от культур микроорганизмов для перемешивания культур животных клеток в реакторах сравнительно часто применяется устройство типа «вибромиксер», представляющее собой плоский круглый диск с несколькими отверстиями, укрепленный в горизонтальном положении на конце вала у дна реактора. Быстрое перемещение вала вверх и вниз и соответствующее колебательное движение перфорированного диска вызывают циркуляцию перемешиваемой жидкости. Для культур животных клеток применялись и эрлифтные системы, аналогичные рассмотренным выше.
 В случае культур животных клеток понятие о крупномасштабном процессе приобретает несколько иной смысл. В силу высокой стоимости продукта процесса и высоких эксплуатационных расходов реактор объемом 10 л уже может считаться крупномасштабным, а реактор объемом 100 л, безусловно, относится к числу очень больших.
В случае культур животных клеток понятие о крупномасштабном процессе приобретает несколько иной смысл. В силу высокой стоимости продукта процесса и высоких эксплуатационных расходов реактор объемом 10 л уже может считаться крупномасштабным, а реактор объемом 100 л, безусловно, относится к числу очень больших.
Преимущественное применение относительно небольших реакторов отчасти обусловлено и довольно низкой скоростью роста животных клеток. На рис. 41 представлены данные, характеризующие рост периодической культуры клеток аденокарциномы печени человека (линия SK-HEP-1).
РИС. 41. Изменения, происходящие в периодической культуре суспензии клеток SK-HEP-1 (аденокарциномы печени человека), во времени; объем культуры 100 л. Штриховая линия на верхнем графике отвечает экспоненциальному росту со временем удвоения 62 ч. Спустя трое суток начинают барботировать чистый кислород со скоростью 0,2 мл/мин. [Воспроизведено с разрешения из статьи: Tolbert W. R., Schoenfled R. А., Lewis е., Feder /., Large-Scale Mammalian Cell Culture: Design and Use of an Economical Batch Suspension System; Biotech, Bioeng., 24, 1671 (1982).]
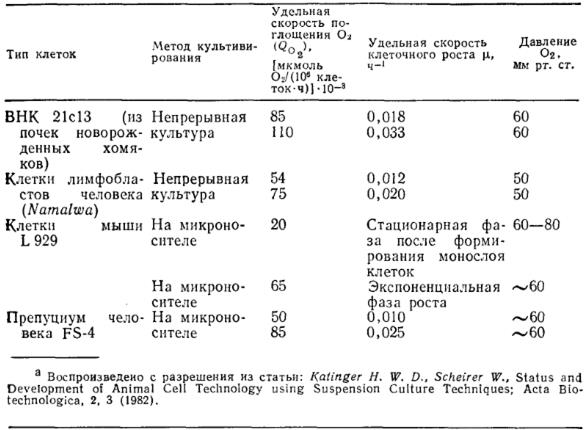
В табл. 14 суммированы экспериментально найденные удельные скорости клеточного роста и скорости поглощения кислорода для нескольких линий клеток; в первых двух случаях клетки выращивали в суспензии в ферментере эрлифтного типа, а клетки двух других типов представляли собой линии, растущие только на твердых поверхностях; особенности культивирования таких клеток мы вкратце рассмотрим ниже.
Показано, что очень высокая локальная плотность клеток может быть достигнута двумя различными методами иммобилизации — спомощью ультрафильтрационных мембран или путем микрокапсулирования. Хотя принципы иммобилизации животных клеток и клеток микроорганизмов в общих чертах одинаковы, к иммобилизации относительно больших по размерам животных клеток предъявляются и свои специфические требования. В одном очень перспективном способе микрокапсулирования клетки сначала включают в гранулы альгината (см. рис.27). Затем на гранулы наносят слой полилизина и последний сшивают поперечными связями, после чего альгинатный гель можно удалить растворением. В этом случае находящиеся внутри полилизиновой капсулы клетки после стадии роста могут заполнить весь объем внутри капсулы, и их плотность приблизится к плотности в тканях. Подобные катализаторы перспективны с точки зрения возможности достижения более высокой производительности реакторов (в расчете на единицу объема).
Таблица 14. Удельные скорости клеточного роста и поглощения кислорода для клеток различных линий. Рост непрерывной культуры осуществляли в реакторе колонного типа с барботажема
Специфические проблемы возникают при увеличении масштаба биореакторов с клетками, растущими на поверхностях. Для вращающихся сосудов отношение площади поверхности к объему мало, поэтому переход к аналогичным сосудам большего объема практически нецелесообразен. Предложено несколько способов увеличения отношения площади поверхности биореактора к его объему (S/V) и, следовательно, объемной плотности растущих на поверхностях клеток. Ряд конструктивных решений этой задачи схематично изображен на рис. 42; здесь же приведены соответствующие величины S/V.
 Из различных принципиально возможных путей решения задачи в последние годы наибольшее внимание уделяется микроносителям — небольшим бусинам, на поверхности которых могут расти клетки и которые можно суспендировать в культуральной жидкости. Основное преимущество микроносителей связано свозможностью их использования в тех же реакторах и с теми же перемешивающими устройствами, которые применяются для процессов с участием животных клеток без носителей. Потенциальные возможности микроносителей впервые были продемонстрированы на заряженных декстрановых бусинах. Наблюдавшееся в первых экспериментах ингибирование клеточного роста удалось позднее подавить путем изменения состава бусин и снижения их поверхностного заряда.
Из различных принципиально возможных путей решения задачи в последние годы наибольшее внимание уделяется микроносителям — небольшим бусинам, на поверхности которых могут расти клетки и которые можно суспендировать в культуральной жидкости. Основное преимущество микроносителей связано свозможностью их использования в тех же реакторах и с теми же перемешивающими устройствами, которые применяются для процессов с участием животных клеток без носителей. Потенциальные возможности микроносителей впервые были продемонстрированы на заряженных декстрановых бусинах. Наблюдавшееся в первых экспериментах ингибирование клеточного роста удалось позднее подавить путем изменения состава бусин и снижения их поверхностного заряда.
РИС. 42. Аппараты и устройства, обеспечивающие высокую площадь поверхности контакта животных клеток со средой, а — пучок искусственных капилляров (обычно полупроницаемых) (S/V=31 см-1); б — гранулированные носители (S/V=120 см-1 при плотности 20 г гранул в 1 л); в — свернутый лист (с прокладками, обеспечивающими постоянное расстояние между витками) (S/V=4 см-1); г — культиватор с параллельными пластинами (и эрлифтным устройством) (S/V=1,7 см-1);д — наклоненные вращающиеся сосуды (отдельный сосуд или вращающийся стенд, вмещающий до нескольких сотен сосудов) (S/V=0,2—0,7 см-1).
Один из выпускаемых в промышленном масштабе и поступающих в продажу микроносителей состоит из бусин поперечно-связанного декстрана, на которые нанесен слой денатурированного коллагена, ковалентно связанного с декстраиовой основой. Сообщалось, что плотность такого катализатора в реакторе для культур клеток может составлять от 3 до 25 г/л.
Переход от исходной чистой культуры к культуре с высокой плотностью клеток в большом реакторе обычно осуществляют ступенчато с постепенным повышением масштаба. На рис. 43 схематично изображены основные стадии операции по повышению масштаба для суспензионной и растущей на поверхностях культур животных клеток. Обратите внимание на то, что здесь объем инокулята, переносимого в следующий по масштабу реактор, довольно велик по сравнению с системами на основе культур микроорганизмов.
Культуры животных клеток выращивают в различных режимах. Наряду с простым периодическим режимом применяют и ступенчатый периодический режим, при котором по окончании одного периодического процесса определенную часть культуры используют как посевной материал для другого реактора, где и происходит затем окончательное созревание клеток.
РИС.  43. Увеличение масштаба культур животных клеток (на примере ВНК 21—клеток из почек новорожденного хомяка). В скобках указано общее количество клеток, образующихся на данной стадии. [Воспроизведено с разрешения из статьи: Katinger Н. W. D., Scheirer W., Status and Development of Animal Cell Technology using Suspension Culture Techniques; Acta Biotcchnologica, 2, 3 (1982).]
43. Увеличение масштаба культур животных клеток (на примере ВНК 21—клеток из почек новорожденного хомяка). В скобках указано общее количество клеток, образующихся на данной стадии. [Воспроизведено с разрешения из статьи: Katinger Н. W. D., Scheirer W., Status and Development of Animal Cell Technology using Suspension Culture Techniques; Acta Biotcchnologica, 2, 3 (1982).]
Другим вариантом являются периодические процессы с добавлением субстрата, в которых по мере роста клеток в культуру вводят питательные вещества по определенной программе или в соответствии с данными анализов. В перфузионной системе клетки удерживаются в реакторе, а среда частично замещается на свежую; такая система представляет собой вариант рассмотренных ранее методов иммобилизации клеток в масштабе всего реактора. Наконец, использовались и непрерывные культуры с постоянным обновлением как клеток, так и среды. Обновление среды позволяет снизить эффекты ингибирования, обусловленные накоплением продуктов клеточного метаболизма. Действительно, аммиак ингибирует клеточный рост в концентрациях выше 4 мМ.
Скорость образования продуктов метаболизма животных клеток может варьировать в очень широких пределах в зависимости от типа процесса и пути образования данного продукта метаболизма. В некоторых случаях скорость образования метаболита связана с клеточным ростом. В других ситуациях после того, как клетки прошли определенную стадию роста, в систему вводят те или иные вещества-предшественники, из которых позднее и образуется продукт метаболизма. В производстве вирусов, в котором клетки, по сути дела, являются для них питательной средой, может наблюдаться очень сложная кинетика. В литературе, посвященной изучению применения культур животных клеток для получения вирусов, клеточный слой обычно называют «субстратом». Посев вируса часто производят только после того, как культура клеток достигнет высокой плотности. Затем вирусы развиваются в соответствии со своим жизненным циклом, включающим стадии проникновения вируса в клетку, синтеза его отдельных компонентов и сборки частиц вируса из этих компонентов; только после этого вирус можно обнаружить в клетках или среде.
 Разработка способов производства моноклональных антител может служить примером тех потенциальных возможностей, которые заложены в оптимизации процессов с участием животных клеток. Гибридомы клеток мыши выращивали в периодической, периодической с добавлением субстрата и в непрерывной культурах с целью получения моноклональных антител для поверхностного антигена клеток Rhizobium japonica NR-7* (* Reuveny S., Velez D., Riske F., Macmillan J. D., Miller L., Production of Monoclonal Antibodies in Culture; E.S.C.A.T. Mtg,, Italy, May, 1984).
Разработка способов производства моноклональных антител может служить примером тех потенциальных возможностей, которые заложены в оптимизации процессов с участием животных клеток. Гибридомы клеток мыши выращивали в периодической, периодической с добавлением субстрата и в непрерывной культурах с целью получения моноклональных антител для поверхностного антигена клеток Rhizobium japonica NR-7* (* Reuveny S., Velez D., Riske F., Macmillan J. D., Miller L., Production of Monoclonal Antibodies in Culture; E.S.C.A.T. Mtg,, Italy, May, 1984).
Изучение различных сред показало, что для данного случая подходит недорогая среда типа Dulbecco's Modified Eagle Medium, к которой добавлено 0,25% приматона RL, 0,01% детергента плюроник F-68 и совсем немного (1%) сыворотки эмбрионов крупного рогатого скота. В этой среде концентрация клеток в суспензии достигает 2-106 мл-1 при времени удвоения 24 ч. Для этого процесса не было предложено детальной модели кинетики клеточного роста, но полученные результаты тем не менее представляют большой интерес (рис. 44 и 45).
 РИС. 44. Рост гибридом и образование моноклональных антител в ферментере объемом 3 л при различных концентрациях растворенного кислорода. (Воспроизведено с разрешения из статьи: Reuveny S., Valez D., Riske F., Macmillan J. D., Miller L., Production of Monoclonal Antibodies in Culture;E.S.C.A.T. Mtg., Italy, May, 1984.)
РИС. 44. Рост гибридом и образование моноклональных антител в ферментере объемом 3 л при различных концентрациях растворенного кислорода. (Воспроизведено с разрешения из статьи: Reuveny S., Valez D., Riske F., Macmillan J. D., Miller L., Production of Monoclonal Antibodies in Culture;E.S.C.A.T. Mtg., Italy, May, 1984.)
РИС. 45. Сравнение методов получения моноклональных антител в периодическом процессе(б) и в периодическом процессе с добавлением свежей среды (а). Культуру выращивали во вращающихся сосудах емкостью 100 мл. В периодическом процессе с добавлением свежей среды каждые 24 ч к культуре добавляли 5—10% среды, а 30% культуры периодически отбирали. (Воспроизведено с разрешения из работы; Reuveny S., Valez D., Riske F., Macmillan J. D., Miller L., Production of Monoclonal Antibodies in Culture; E.S.C.A.T. Mtg., Italy, May, 1984.)
Снижение концентрации растворенного кислорода (с 60 до 25% относительно концентрации при насыщении воздухом) привело к уменьшению максимальной плотности клеток в культуре, но способствовало увеличению времени жизни культуры, так что окончательная концентрация моноклональных антител оказалась более высокой (рис. 44).
Высказывалось предположение, что в любых условиях образуется ингибитор клеточного роста. Если это предположение справедливо, то периодический процесс с добавлением субстрата должен дать лучшие результаты в силу ступенчатого снижения концентрации ингибитора. С этой гипотезой согласуются результаты сравнительного изучения периодических процессов с добавлением и без добавления субстрата (рис. 45); действительно, и жизнеспособность клеток, и концентрация антител выше в периодическом процессе с добавлением субстрата. Небольшие количества моноклональных антител удобнее получать в брюшной полости мыши, однако крупномасштабное производство антител целесообразнее осуществлять в биореакторах с недорогой питательной средой в условиях, обеспечивающих максимальное время жизни клеток и наибольший выход антител. Для роста гибридом и получения продуктов их жизнедеятельности (моноклональных антител) в большом масштабе перспективно применение культур клеток, иммобилизованных в полых волокнах или с помощью полупроницаемых мембран.
Дата добавления: 2020-10-01; просмотров: 613;











