Взаимосвязь между перемешиванием и биологическими превращениями
Характер течений и явления переноса влияют на кинетику клеточных процессов в различных масштабах. Так, эффекты, проявляющиеся при определенных масштабах длины (вспомните рис. 9.2), могут различными путями влиять на наблюдаемую кинетику роста популяции клеток. Эти влияния необходимо учитывать с тем, чтобы изучение кинетики и разработка моделей осуществлялись в условиях, аналогичных в основном условиям в большом реакторе. В настоящем разделе мы изучим некоторые стороны взаимосвязи между кинетикой клеточного роста и перемешиванием в биореакторах.
Изучение начнем с анализа наибольшего масштаба, включающего циркуляцию всей жидкой фазы, в результате которой клетки переносятся в различные зоны реактора, где, как мы уже отмечали, в случае больших аппаратов обычно имеются разные концентрации растворенного кислорода и различные уровни турбулентности. Влияние циркуляции жидкой фазы на общую кинетику клеточного роста можно понять, обратившись к простому примеру. Предположим, что кислород подается локально в какую-то определенную зону реактора (как обычно и бывает в случае реакторов с перемешиванием) и что утилизация кислорода происходит в изолированных элементах жидкости, циркулирующих в реакторе. Такая ситуация может возникнуть в высоковязких микробиологических системах. Если начальная концентрация кислорода в воде близка к уровню насыщения (0,3 моль/м3) и если кислород поглощается с обычной скоростью 10—100 моль/(ч-м3), то в отдельном элементе системы кислород истощится через 11—50 с. Эта величина имеет тот же порядок, что и время циркуляции в большом реакторе.
Для того чтобы оценить влияние циркуляции жидкой фазы с количественной стороны в более общем виде, а также чтобы учесть статистическое распределение времен циркуляции, рассмотрим работу реактора периодического действия с распределением времени циркуляции fc(t). Допустим далее, что в полностью сегрегированных элементах жидкой фазы осуществляется реакция нулевого порядка. Распространение этой модели на другие типы локальной кинетики реакций, в том числе и на реакции, описываемые уравнением Михаэлиса — Ментен, не представляет принципиальных затруднений, а только немного усложняет соответствующие расчеты, но все выводы качественного характера при этом сохраняют свою силу. В реакции нулевого порядка, константа скорости которой равна k0, при начальной концентрации реагента s0 его концентрация в элементе жидкой фазы будет изменяться согласно уравнениям:
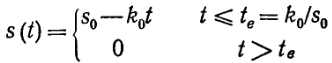 (90)
(90)
Здесь мы впервые ввели параметр времени истощения питательного вещества te, равный k0/s0. Далее символом F обозначим долю времени, которую элемент жидкости находится в условиях полного истощения питательного вещества. Эту долю можно рассчитать по уравнению:
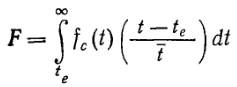 (91)
(91)
 где t — среднее время циркуляции. Уравнение (9.91) было решено при различных относительных величинах t, te и различных стандартных отклонениях σ распределения времен выравнивания концентраций при условии, что fc(t)—логарифмически нормальное распределение. Представленные на рис. 9.20 результаты показывают, что время пребывания клеток в истощенной среде возрастает при увеличении как среднего времени циркуляции, так и стандартного отклонения времени циркуляции. Параметр 1—F можно интерпретировать как отношение реального выхода продукта процесса к выходу, который был бы достигнут при условии подачи питательного вещества ко всем точкам объема реактора. Эти расчеты показывают, что при данном времени циркуляции реактор должен иметь такую конструкцию, которая бы обеспечивала минимальную дисперсию времени выравнивания концентраций перемешиваемых веществ.
где t — среднее время циркуляции. Уравнение (9.91) было решено при различных относительных величинах t, te и различных стандартных отклонениях σ распределения времен выравнивания концентраций при условии, что fc(t)—логарифмически нормальное распределение. Представленные на рис. 9.20 результаты показывают, что время пребывания клеток в истощенной среде возрастает при увеличении как среднего времени циркуляции, так и стандартного отклонения времени циркуляции. Параметр 1—F можно интерпретировать как отношение реального выхода продукта процесса к выходу, который был бы достигнут при условии подачи питательного вещества ко всем точкам объема реактора. Эти расчеты показывают, что при данном времени циркуляции реактор должен иметь такую конструкцию, которая бы обеспечивала минимальную дисперсию времени выравнивания концентраций перемешиваемых веществ.
РИС. 20. Зависимость времени пребывания клеток в циркулирующих элементах жидкой фазы в условиях истощения питательных веществ от относительного времени циркуляциии стандартного отклонения времени циркуляции).
Описанная модель, хотя и обладает некоторой информативностью, но не учитывает того влияния, которое могут оказывать на кинетику клеточного роста изменения условий во времени, обусловленные циркуляцией культуральной жидкости в реакторе. Как мы уже видели на рис. 1, масштабы времени циркуляции в больших биореакторах сравнимы с масштабами времени некоторых метаболических превращений и адаптационных изменений. Это говорит о том, что модель, разработанная для специфических условий перемешивания в малом реакторе, может оказаться несостоятельной в случае большого аппарата, для которого характерны большое время выравнивания концентраций перемешиваемых компонентов и большие флуктуации условий процесса.
Эксперименты, выполненные с помощью встроенного непосредственно в реактор флуориметрического устройства, описываемого подробнее в разд. 2, наглядно показали близость времени выравнивания концентраций и биологического отклика системы. Время выравнивания концентраций в аэрируемом (0,5% по объему) 70-литровом реакторе с механическим перемешиванием (рабочий объем 40 л) определяли путем импульсного введения раствора хинина в 0,05 М H2SO4 и последующего контроля изменения флуоресценции культуры во времени. Эти изменения позволили определить процессы циркуляции жидкой фазы и смешивания в реакторе. Затем флуоресценцию измеряли после импульсного введения глюкозы в культуру дрожжей. В этом случае источником флуоресценции являлись внутриклеточные восстановленные нуклеозиды, концентрации которых в большой степени зависят от скорости превращений глюкозы в клетке. Таким образом, результаты второго эксперимента дают ценную информацию о времени отклика полной последовательности процессов переноса (смешение с жидкой фазой → диффузия к клеткам → транспорт в клетки) и метаболических превращений, связанных с утилизацией питательного вещества.
Таблица 3. Сравнение времени выравнивания концентраций в аэрируемом (0.5% по объему) реакторе объемом 70 л (рабочий объем 40 л) и времени отклика процесса утилизации глюкозы дрожжами (в секундах) при различных скоростях перемешиванияa
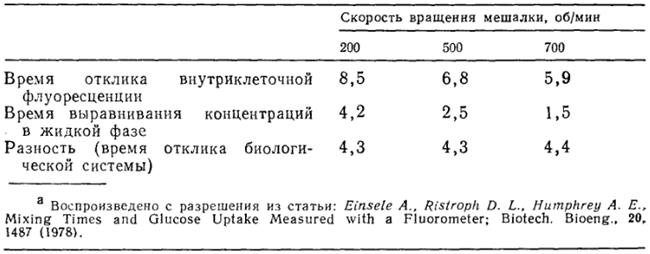
В табл. 3 приведены время выравнивания концентраций и время отклика процесса утилизации субстрата, найденные для этого реактора при различных скоростях перемешивания. Интересно отметить, что время отклика процесса утилизации глюкозы, как и можно было предположить, практически одно и то же во всех трех случаях, а время выравнивания концентраций при повышении скорости перемешивания существенно снижается. Эти данные интересны и с еще одной точки зрения — обращает на себя внимание сходство порядка величин времени отклика процесса локального поглощения и утилизации глюкозы и времени выравнивания концентраций в растворе. Отсюда следует, что в ходе циркуляции клетки сталкиваются с различными условиями в разных зонах реактора и, вероятно, постоянно находятся в некотором переходном метаболическом состоянии, поскольку время отклика метаболизма мало отличается от характерного масштаба времени изменения условий в среде, обусловленного циркуляцией культуры.
В некоторых экспериментах наблюдалось заметное влияние неоднородности среды на метаболизм клеток. Так, в трубчатом реакторе с линией циркуляции, в которой наблюдаются колебания концентрации растворенного кислорода, в культуре Candida tropicalis повышается экономический коэффициент образования биомассы относительно субстрата, снижается скорость потребления кислорода, расходуемого на образование биомассы, понижается дыхательный коэффициент. При колебании концентрации растворенного кислорода в проточной культуре Pseudomonas methylotropha ASI, растущей на метаноле как источнике углерода и энергии, наблюдались противоположные эффекты — снижение скорости клеточного роста и экономического коэффициента образования биомассы по субстрату. В другом эксперименте в культуре Репісіllіит chrysogenum P1 концентрацию растворенного кислорода изменяли периодически (с периодом 2 мин), так что средняя концентрация О2 составляла 30% от концентрации при насыщении воздухом. В данном случае удельная скорость биосинтеза пенициллина существенно снижалась, причем в общих чертах этот эффект напоминал влияние понижения средней концентрации растворенного кислорода, что свидетельствовало о нелинейном характере влияния изменений условий на биореакцию.
Если перейти к анализу более мелкомасштабных флуктуации скорости турбулентного течения жидкой фазы, то логично ожидать существенного влияния интенсивности турбулентных вихрей различных масштабов на морфологию (и, вероятно, на характер метаболизма) некоторых организмов. Можно далее предположить, что эта зависимость будет иметь наибольшее значение в случае организмов, вырастающих до размеров, масштаб которых сравним с ожидаемым масштабом турбулентных вихрей. Последние в свою очередь изменяются от крупномасштабных (соответствующих масштабу высоты лопасти мешалки, например 0,1 м) до самых мелкомасштабных, образующихся в каскаде передачи энергии турбулентного потока (разд. 8.3). В биореакторах с перемешиванием размер самых мелких вихрей равен примерно 20—100 мкм. Чтобы определить, на какие биологические системы флуктуации скоростей в этом масштабе будут влиять в наибольшей степени, можно обратиться к рис. 2. Нетрудно видеть, что размеры скоплений микроорганизмов (особенно мицелиальных) соответствуют среднемасштабным турбулентным вихрям, и, следовательно, интенсивность перемешивания и распределение зон турбулентности в реакторе будут оказывать влияние в основном именно на эти образования.
 РИС. 21. Зависимость концентрации лимонной кислоты, образовавшейся через 7 сут в культуре Aspergillus niger, от скорости вращения турбинной мешалки (кривые 1, 2 и 3 отвечают штаммам S59, N233 и Е81 соответственно), а также зависимость количества сухой биомассы, образующейся в культуре штамма S59, от того же параметра (кривая 4). [Воспроизведено с разрешения из статьи; Ujcova Е., Fencl Z., Musi'lkova М., Siechert L, Dependence of Release of Nucleotides from Fungi on Fermentor Turbine Speed; Biotech. Bioeng., 22, 237 (1980).]
РИС. 21. Зависимость концентрации лимонной кислоты, образовавшейся через 7 сут в культуре Aspergillus niger, от скорости вращения турбинной мешалки (кривые 1, 2 и 3 отвечают штаммам S59, N233 и Е81 соответственно), а также зависимость количества сухой биомассы, образующейся в культуре штамма S59, от того же параметра (кривая 4). [Воспроизведено с разрешения из статьи; Ujcova Е., Fencl Z., Musi'lkova М., Siechert L, Dependence of Release of Nucleotides from Fungi on Fermentor Turbine Speed; Biotech. Bioeng., 22, 237 (1980).]
В предыдущих главах мы уже обсуждали связанное с диффузионными ограничениями влияние общего размера клеточных скоплений на общие скорости процессов. Здесь же основное внимание мы уделим более скрытым эффектам, включая изменения морфологии и метаболического состояния организмов, в существенной степени. Влияющие на микробиологические процессы. Интересным примером такого рода эффектов является влияние интенсивности перемешивания на рост, образование продуктов жизнедеятельности и секрецию нуклеотидов в среду в случае различных мутантов Aspergillus niger — эффективных продуцентов лимонной кислоты. Как показано на рис. 21, при повышении интенсивности перемешивания возрастает урожай биомассы, однако зависимость скорости биосинтеза лимонной кислоты от интенсивности перемешивания носит более сложный характер и в случае всех трех изученных мутантов характеризуется наличием четко выраженных максимумов. Параллельное изучение зависимости процесса секреции нуклеотидов в среду от скорости перемешивания показало, что характер этой зависимости определяется природой штамма. Для ряда штаммов убыстрение вращения мешалки сопровождалось увеличением концентрации нуклеотидов в среде, а для другого штамма совершенно неожиданно была обнаружена обратная зависимость, когда при более высоких скоростях вращения мешалки скорость секреции нуклеотидов снижалась. Влияние скорости вращения мешалки на морфологию мицелия этого необычного мутанта представлено на рис. 22. На микрофотографиях видно, что при низких скоростях перемешивания мицелий имеет длинные, тонкие и мало разветвленные филаменты с небольшим числом септ, в то время как при высоких скоростях перемешивания преобладают толстые, в высшей степени септированные, более разветвленные и скрученные гифы. Этот пример показывает, что интенсивность перемешивания может оказывать на организмы большое влияние, в существенной степени определяющее кинетику всего процесса.
В обсуждении материала этого раздела и в приведенных примерах мы старались подчеркнуть потенциально сложную реакцию растущих клеток на физические и химические параметры окружения и невозможность разработки общей математической модели кинетики, применимой при любых обстоятельствах. Поэтому необходимы тщательный учет совместного влияния химических и физических параметров среды в данном биореакторе и применение соответствующего математического описания кинетики процессов, необходимого именно в данной ситуации. Очевидны трудности, связанные с масштабным переходом в случае систем, кинетика которых отличается высокой чувствительностью к флуктуациям параметров окружения. В этих случаях нужно попытаться найти такую конструкцию реактора, которая обеспечивала бы определенные (но не обязательно одинаковые во всем объеме) параметры окружения, что может быть чрезвычайно трудной задачей, если речь идет о крупномасштабных реакторах. Выбрав реактор иной конструкции (см. разд. 9.7), иногда удается снизить разброс в значениях времени выравнивания концентраций и степени флуктуаций параметров окружения и тем самым получить более определенную картину смешения, для которой легче подыскать соответствующее математическое выражение, описывающее кинетику процесса. Однако в общем случае нельзя рассчитывать на успех рационального, заранее спланированного масштабирования биореакторов до тех пор, пока мы не будем лучше понимать процессы переноса в различных масштабах и кинетику биореакций на нескольких условиях сложности и пока не сможем объединить эти данные с тем, чтобы достаточно надежно рассчитать работу реактора на основе одних лишь теоретических данных.

РИС. 22. На этих микрофотографиях отчетливо видно различие в морфологии и септации клеток А. niger S59, выращенных при 400 (а) и 1200 (б) оборотах в минуту (увеличение Х400). [Воспроизведено с разрешения из статьи: Ujcova E., Fencl Z., Musi'lkova М., Siechert L., Dependence of Release of Nucleotides from Fungi on Fermentor Turbine Speed; Biotech. Bioeng., 22, 237 (1980).]
Стерилизаторы
Жидкости, обычно водные растворы, можно стерилизовать несколькими методами, в том числе облучением (ультрафиолетовым или рентгеновским излучением), воздействием ультразвука, фильтрованием, нагреванием и обработкой особыми химическими агентами. В крупномасштабном производстве широко применяются только два последних метода, хотя сравнительно небольшие количества растворов неустойчивых витаминов и других сложных соединений иногда стерилизуют путем пропускания через пористые мембраны. В этом разделе основное внимание будет уделено процессам и аппаратам для стерилизации путем тепловой обработки.
Необходимые для разрушения жизнеспособных микроорганизмов и вирусов условия могут изменяться в очень широких пределах в зависимости от природы стерилизуемого объекта и сферы его последующего использования. Иногда, например при квашении капусты или при биологической очистке сточных вод, необходимые превращения обеспечивают уже присутствующие в системе микроорганизмы. В процессах производства спирта, винного уксуса и заготовки силоса быстро вырабатываются ингибиторы, подавляющие рост нежелательных организмов, поэтому здесь требования к стерилизации также невысоки. Пастеризация молока сопровождается гибелью большинства, но далеко не всех активно растущих микроорганизмов. Более жесткая обработка молока опасна из-за деструкции его полезных компонентов. Вообще оптимальный баланс между разрушением полезных компонентов и гибелью нежелательных микроорганизмов играет основную роль в выборе метода стерилизации и пастеризации, а также при расчете соответствующих аппаратов.
Процессы с участием чистых культур, работа с культурами тканей и обработка некоторых пищевых продуктов требуют гораздо более жесткой стерилизации. В таких случаях систему необходимо практически полностью освободить от всех нежелательных микроорганизмов, хотя «полнота» стерилизации также зависит от конкретной системы. По экономическим соображениям, например, для периодического процесса допустима вероятность заражения [(1—Р0) в уравнении порядка 10-2. Это означает, что один процесс из каждых 100 может быть забракован именно из-за недопустимо высокого заражения. С таким ущербом можно примириться, если стоимость потерь сравнима со стоимостью дополнительного стерилизующего оборудования.
Значительно более жесткие правила приняты в консервной промышленности. Здесь необходима действительно полная стерилизация, поскольку единственная жизнеспособная спора Clostridium botulinum может, в конце концов, привести к смертельному отравлению. Обычно в такой ситуации основное требование, предъявляемое к процессу стерилизации, состоит в снижении вероятности выживания спор (1—Р0) до величины менее 10-12. Этот пример наглядно демонстрирует опасность даже небольших отклонений от совершенно полного превращения субстрата (спор и вегетативных клеток) в продукты процесса (инактивированные споры, погибшие клетки) в стерилизационных реакторах. Отсюда следует, что расчет таких реакторов необходимо выполнять чрезвычайно тщательно. Сначала мы рассмотрим периодические, а затем непрерывные процессы стерилизации.
Дата добавления: 2020-10-01; просмотров: 783;











