Биологические свойства
Коллоидная цитоплазма удерживается в плазматической мембране. Крупные молекулы не могут пройти через эту мембрану и поэтому они должны расщепиться на более мелкие (например, крахмал до глюкозы)
Живая цитоплазма всегда представляет собой коллоидный раствор и в клетках можно наблюдать броуновское движение мелких частиц.
Казеин молока выпадает в осадок под действием разбавленных кислот или сычужного фермента (последний применяется в сыроделии). Пектиновые вещества, содержащиеся в клеточных стенках плодов, образуют плотный гель при варке джема. Яичный белок необратимо коагулирует при нагревании.
Коллоиды живых клеток адсорбируют различные вещества; особенно это характерно для клеток, участвующих в поглощении ионов, например для клеток коры корня
Один из таких переходов — это свертывание крови, при котором в состояние геля переходит белок фибриноген. Яичный белок переходит из состояния золя в состояние геля в результате нагревания.
Явление набухания лежит в основе поглощения воды кожурой сухого семени или целлюлозой клеточных стенок. Выход гамет из антеридиев (репродуктивных органов споровых растений) также обусловлен набуханием коллоидов.
1.5 Диффузия и осмос
Молекулы и ионы в растворе могут перемещаться пассивно и спонтанно в определенном направлении в результате диффузии. (Осмос — особый вид диффузии) Для такого перемещения в живых организмах — в отличие от активного транспорта — затраты энергии не требуется.
1.5.1 Диффузия
Диффузия связана с беспорядочным и спонтанным движением отдельных молекул и ионов. Если, например, оставить открытой склянку с концентрированным водным раствором аммиака, то очень скоро запах аммиака распространится по всей комнате. Этот процесс распространения молекул аммиака представляет собой диффузию, и, хотя любая молекула может двигаться в любом направлении, реальный поток молекул направлен из склянки наружу, т. е. от источника, где их концентрация велика, в те области, где их концентрация ниже. Диффузию, следовательно, можно определить как движение молекул или ионов из области с высокой концентрацией в область с более низкой концентрацией, иными словами, как движение по градиенту концентрации. В отличие от того, что характерно для объемного потока, реальная диффузия различных типов молекул или ионов может идти одновременно в разных направлениях, при этом каждый тип молекул движется по своему градиенту концентрации. В легких, например, кислород диффундирует в кровь, а диоксид углерода в то же самое время диффундирует из крови в альвеолы, но объемный поток крови в легких может иметь только одно направление. При равных градиентах концентрации мелкие молекулы и ионы диффундируют быстрее крупных. Существует еще особая диффузия, называемая облегченной диффузией.
1.6. Законы термодинамики
Все химические превращения подчиняются законам термодинамики. Первый закон, называемые законом сохранения энергии,гласит, что для любого химического процесса общая энергия системы и ее окружения всегда остается постоянной. Это означает, что энергия не исчезает и не возникает вновь, так что если какая-либо химическая система приобретает энергию, то такое же количество энергии должно изыматься из ее окружения, и наоборот. Энергия, следовательно, может перераспределяться, переходить в другую форму или претерпевать оба этих превращения, но она не может исчезать.
Из второго закона термодинамики следует, что система и ее окружение, будучи предоставлены самим себе, приближаются обычно к состоянию максимальной неупорядоченности (энтропии).Это значит, что высокоупорядоченные системы легко разрушаются, если на поддержание их упорядоченности не затрачивается энергия. Все биологические процессы подчиняются этим двум законам термодинамики и управляются ими.
1.6.1 Энергетические соотношения в живых системах
Рассмотрим разложение пероксида водорода на кислород и воду:
2Н2О2 ↔ 2Н2О + О2
Вообще чистый пероксид водорода может существовать в течение длительного времени и заметно не разлагаться. Для того чтобы произошло разложение, его молекулы при столкновении должны иметь энергию, превышающую определенный уровень, называемый энергией активации,Еа. Когда этот активационный барьер достигнут, в молекулах изменяется характер связей и реакция генерирует достаточно энергии для того, чтобы идти спонтанно. Величина энергии активации для разных реагентов различна.
Нагревание — самый простой способ достичь энергии активации; большей части реагентов необходимы гораздо большие количества тепловой энергии, нежели те, какими они обладают при обычных температурах. Так, разложение пероксида водорода уже при 150 °С идет настолько быстро, что реакция становится взрывоподобной. В этой реакции образуются вода и кислород и выделяется энергия. Общее изменение энергии, происходящее в результате реакции, называют изменением свободной энергии(ΔG). Поскольку данная реакция протекает очень быстро, а ее продукты — вода и кислород — в обычных условиях не соединяются вновь, т. е. обратной реакции не происходит, высвободившаяся энергия фактически теряется — переходит от этой химической системы в окружающую среду. Величина ΔG является, таким образом, отрицательной (рис. П.1.З.).
Для биологических систем высокие температуры губительны, и здесь их действие заменяется действием ферментов. Выступая в качестве катализаторов, ферменты снижают энергию активации, необходимую данным реагентам, и таким путем обеспечивают более высокие скорости реакций без добавления энергии извне, т. е., в частности, без повышения температуры. В живых системах быстрое разложение пероксида водорода происходит под действием фермента каталазы.
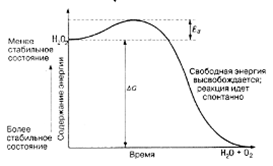
Рис. 3 Энергия активации
1.6.2 Потенциальная энергия
Потенциальная энергия — это та энергия, которой обладает система в силу своего положения и существующих условий. Представим себе шар, неподвижно лежащий у края наклонной плоскости (рис. П. 1.4). Этот шар обладает гравитационной потенциальной энергией, эквивалентной той работе, которую пришлось выполнить, чтобы поместить его в данное место. Еслишар скатится вниз, то часть его потенциальной энергии превратится в кинетическую. Когда теперь он остановится внизу, его потенциальная энергия будет меньше, чем она была наверху. Чтобы восстановить потенциальную энергию шара до ее исходного значения, потребуется снова поднять шар наверх за счет энергии, заимствованной из окружения.
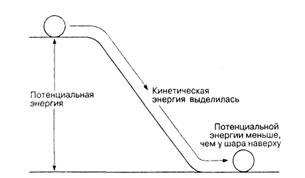
Рис. 4Потенциальная и кинетическая энергия.
Потенциальную энергию для биологических систем накапливают зеленые растения в процессе фотосинтеза, когда они синтезируют сахара (рис. П.1.5.). Во время этого процесса некоторые электроны под действием солнечной энергии переходят на другой, более высокий энергетический уровень, приобретая таким образом потенциальную энергию. Затем, когда при дыхании происходит окисление сахароз, потенциальная энергия этих электронов используется в различной форме живыми системами.
Свободная энергия,
поставляемая
эндергоническим
реакциям
▲
 АДФ + Фн
АДФ + Фн
АТФ
▲
Дыхание
(экзергонический процесс)
▲
Сахар (потенциальная энергия)
▲
Фотосинтез зеленых растений
(эндергонический процесс)
▲
Солнце
(источник свободной энергии)
Рис. 5. Поток энергии в биологических системах.
ПРИЛОЖЕНИЕ 2
Уровни организации белка. Структура белков.

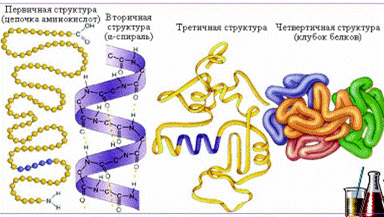
При изучении состава белков было установлено, что все они построены по единому принципу и имеют четыре уровня организации: первичную, вторичную, третичную и четвертичную.
Первичная структура белка – последовательность чередования аминокислотных остатков (все связи ковалентные, прочные). Причем аминокислоты располагаются не хаотично, а в определенной последовательности. Первичную структуру белка стабилизируют пептидные связи между аминокислотными остатками, дисульфидныесвязи между свободными SH-группами и
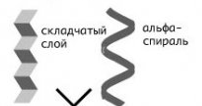
Рисунок 6 - Виды вторичной спирали
Вторичная структура – форма полипептидной цепи в пространстве. Существуют две конформации:
- α-спираль;
- β-структура
Вторичную структуру белка стабилизируют водородные связи. Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль (за счет гидрофобных связей), у некоторых белков – S–S-связи (бисульфидные связи). Поддержанию третичной структуры белка способствуют в основном гидрофобные связи, которые образуются внутри молекулы.
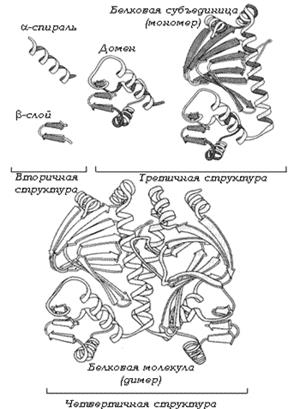
Рисунок 7- Образование третичной и четвертичной структуры
Четвертичная структура – соединенные друг с другом макромолекулы белков образуют комплекс. Четвертичная структура стабилизируется за счет водородныхсвязей, а также вследствие электростатических взаимодействий между аминокислотными остатками расположенными на поверхности молекулы.
Дата добавления: 2016-07-18; просмотров: 1845;











