Экспрессирующие векторы для работы с клетками млекопитающих (ЭВМ)
Внехромосомные экспрессирующие векторы млекопитающих используются для изучения функций и регуляции генов млекопитающих. Кроме того, с их помощью могут быть получены аутентичные рекомбинантные белки, которые потенциально могут быть применимы в медицинских целях для лечения некоторых заболеваний человека. Уже сконструированные экспрессирующие векторы млекопитающих весьма многочисленны, но все они обладают сходными свойствами и похожи на другие эукариотические экспрессирующие векторы (рис. 56).
Полилинкер, представляющий собой множественный сайт клонирования (МСК), и селективный маркер (СМ) находятся под контролем эукариотического промотора и сигнала полиаденилирования или терминации. Обычно используют регуляторные последовательности ДНК вирусов животных (например, цитомегаловируса человека, SV40 или HSV) или генов млекопитающих (гена β-актина, металлотионеина, тимидинкиназы или гена гормона роста). Репликация в клетках E.coli и в клетках млекопитающих обеспечивается соответствующими сайтами инициации репликации: ori плазмиды colEI и, например, обезьяньего вируса 40 (SV40). Для отбора трансформированных клеток E.coli используется ген устойчивости к ампициллину Amp. В качестве селективных маркеров для трансфицированных клеток млекопитающих используют разные гены:
1. Бактериальный ген Neo , кодирующий неомицинфосфотрансферазу, которая обеспечивает устойчивость трансфецированных клеток к токсичному соединению генетицин (G-418).
2. Ген, кодирующий дигидрофолатредуктазу (ДГФР). В этой системе используют клетки с дефектом гена ДГФР, которые не способны расти на среде с метотрексатом. Отобранные клетки пересевают на среды с большей концентрацией метотрексата, отбирая, таким образом, более устойчивые клетки, т.е. содержащие больше копий вектора.
3. Ген фермента глутаминсинтетазы (GS), обеспечивающий устойчивость к цитотоксическому действию метионинсульфоксимина. Вектор, содержащий GS-ген,вводят в культуру клеток млекопитающих и для отбора клеток, несущих большое количество копий вектора, повышают концентрацию метионинсульфоксимина в среде. При этом в хозяйских клетках тоже должна присутствовать GS, поскольку только множественные копии GS-гена могут обеспечивать устойчивость к метионинсульфоксимину.
Химерные белки
Стабильность продукта экспрессии гена-интереса в хозяйской клетке также программируют на стадии конструирования рекомбинантной ДНК. Один из способов защиты продуктов экспрессии чужеродных генов (белков) от деградации в хозяйских клетках – ковалентное присоединение продукта клонированного гена к какому-либо стабильному белку хозяина. Подобная конструкция получила название “химерный белок” или “слитый белок”. Слияние белков программируется на уровне ДНК лигированием кодирующих участков соответствующих генов. При этом следует помнить о рамке считывания, поскольку теоретически нуклеотидная последовательность мРНК в процессе трансляции может быть декодирована с помощью любой из трех различных рамок считывания, причем образующиеся полипептидные цепи будут в этих трех случаях совершенно разными.
В зависимости от предназначения белкового продукта клонированного гена он может использоваться как таковой или в составе химерного белка, что встречается нечасто.
Для удаления балластной (хозяйской) белковой последовательности из химерного белка на уровне ДНК программируют введение сайтов узнавания для протеаз. Олигонуклеотидные линкеры, несущие такие сайты, можно пришить к клонированному гену до того, как такая конструкция будет введена в экспрессирующую векторную систему слияния. Линкером может служить, например, последовательность нуклеотидов, кодирующая олигопептид Ile-Glu-Gly-Arg, узнаваемый фактором крови Ха, который является специфической протеинкиназой (рис. 57).

Рис. 57. Пример встраивания в рекомбинантную ДНК линкерной последовательности, кодирующей внутри слитого белка сайт, узнаваемый специфической протеинкиназой
Создание подобных химерных конструкций широко используется также для контроля за уровнем экспрессии вводимого гена и для определения места локализации его продукта в клетке-хозяине. В этом случае последовательности гена-мишени сливают с генами, которые кодируют нейтральные для клеток белки, наличие которых в тканях может быть легко тестировано. Они получили название – репортерные гены.
Репортерные гены. Чаще всего в качестве репортерных используют гены β-глюкуронидазы (GUS), зеленого флюоресцентного белка (GFP), люциферазы (LUC), хлорамфениколацетилтрансферазы (CAT) и др.
GFP (green fluorescent protein - зеленый флюоресцентный белок, или белок зеленой флюоресценции) был обнаружен Shimomura с соавт. в 1962 г. у люминесцирующей медузы Aequorea victoria. В 2008 г. Нобелевская премия по химии была присуждена группе ученых из США: Osamu Shimomura, Martin Chalfie и Roger Tsien за "открытие и исследование зеленого флюоресцирующего белка", который стал одним из важнейших исследовательских инструментов в биологии, так как позволяет вести наблюдения за процессами в живых клетках
Особые свойства белка GFP, а именно его способность флюоресцировать в видимой (зеленой) области спектра при облучении длинноволновым УФ, обусловлены самой структурой его молекулы и не требуют субстратов или кофакторов.
Многочисленные производные GFP получили общее название AFP (autofluorescent proteins - автофлюоресцентные белки). На рисунке 58 представлены эукариотические клетки, трансфецированные плазмидной ДНК, содержащей в своей структуре гены зеленого (А) и красного (Б) флюоресцирующих белков.
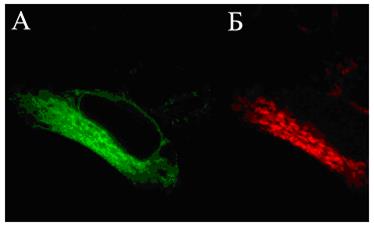
Рис. 58. Клетки линии НЕК-293, трансфецированные плазмидными ДНК, которые содержат репортерные гены зеленого (А) и красного (Б) флюоресцирующих белков
Фотографии сделаны на лазерном сканирующем конфокальном микроскопе “Leica SP2” (увеличение в 400 раз).
Область применения репортерных генов включает контроль переноса и экспрессии чужеродных генов, а также временные и пространственные особенности экспрессии данного конкретного гена, как чужеродного клетке-реципиенту, так и ее собственного
Другие области применения “химерных белков”
Методический прием создания конструкции ДНК с программируемым синтезом продукта в составе химерного белка используют также и для упрощения процедуры очистки рекомбинантного белка. Например, плазмидная конструкция для клеток S.cerevisiae, содержащая ген человеческого интерлейкина-2 с присоединенным к нему сегментом ДНК, кодирующим маркерный пептид Asp-Tyr-Lys-Asp-Asp-Asp-Asp–Lys (он продается под названием Flag), выполняет двоякую функцию: обеспечивает стабилизацию продукта гена интерлейкина-2 и облегчает его очистку. Химерный белок, образующийся после экспрессии этой конструкции в дрожжевых клетках, может быть очищен за один прием с помощью иммуноаффинной хроматографии (рис. 59).
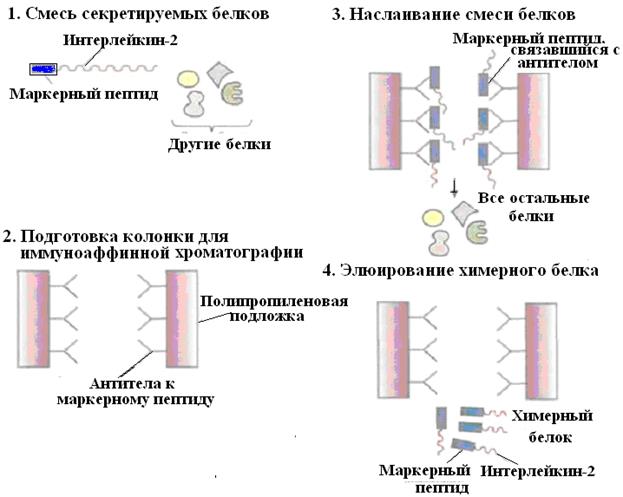
Рис. 59. Очистка химерного белка с помощью иммуноаффинной хроматографии.
Антитела к маркерному пептиду химерного белка фиксируют на твердом носителе и пропускают через колонку химерный белок. Маркерный пептид, входящий в состав химерного белка, связывается с антителами, а все остальные белки свободно проходят через колонку. Очищенный химерный белок элюируют из колонки.
Для скрининга обширных (до 5х10 клонов) библиотек комплементарные ДНК (кДНК), кодирующих редко встречающиеся белки, были разработаны специальные системы слияния. Обычно кДНК встраивают в гены поверхностных белков (белков филаментов или пилей) нитчатых бактериофагов (например М13), или бактерий и после транскрипции и трансляции получают химерные белки, входящие в состав поверхностных структур этих микроорганизмов, где их идентифицируют иммунологически (рис. 60).
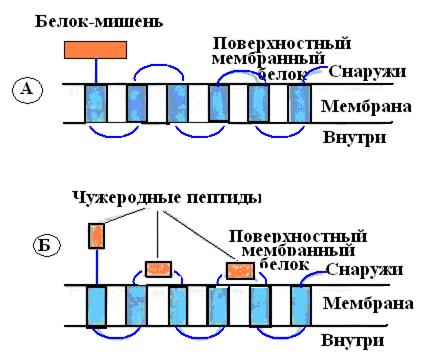
Рис. 60. Химерные белки, состоящие из поверхностного бактериального белка и чужеродного белка- мишени, присоединенного к его N- или С-концу (А) либо включенного в экспонируемые участки молекулы (Б)
Дата добавления: 2016-07-18; просмотров: 3272;











