Влияние опухоли на организм. Паранеопластические синдромы
Паранеопластические синдромы - это совокупность признаков (симптомов), возникающих при выявлении опухоли, сопровождающих ее течение и исчезающих после удаления новообразования.Многие паранеопластические синдромы неспецифичны для определенных видов опухолей, могут возникать за месяцы и годы до развития клинических проявлений опухолевого процесса. Следовательно, многие стойкие отклонения в клинической картине должны вызывать онкологическую настороженность врача. Паранеопластические синдромы подразделяют на кожные, неврологические, психоневрологические, параэндокринные (см. раздел 13.3.4), метаболические (с развитием раковой кахексии), гематологические, сосудистые, почечные, костные, иммунодепрессию (с повышенной подверженностью к инфекционным заболеваниям) и др.
Среди кожных проявленийпаранеопластического синдрома следует отметить эритему Гаммела, чернеющий акантоз, акро- и гиперкератоз, кожную порфирию, ихтиоз, гипертрихоз, псориаз, кожный зуд неясной этиологии, дерматомиозит. К группе неврологических проявленийпаранеопластического синдрома относят мионейропатии (при миеломе, раке легкого и молочной железы), полиневриты, а также синдромы, напоминающие миастению. Часто при раке молочной железы, плоскоклеточном раке почки, яичка, щитовидной железы выявляется паранеопластический синдром гиперкальциемии, который сопровождается развитием неврологических проявлений при отсутствии видимых поражений метастазами костной системы. При аденоме паращитовидных желез и раке легкого отмечаются гиперкальциемия и остеопороз.Конкретным примером паранеопластического синдрома может служить карциноидный синдром, который проявляется усиленной продукцией серотонина, гистамина, ряда нейромедиаторов, гормонов, вызывающих клинические проявления в виде сосудистых изменений.
Среди признаков гематологического паранеопластического синдромавыделяют анемию, не связанную с кровопотерей, эритроцитоз, полиглобулию (почечно-клеточный рак почки, опухоль Вильмса, рак надпочечников). Нередко при опухолях наблюдаются эозинофилия, моноцитоз, тромбоцитоз, лейкоцитоз, повышение СОЭ, нарушения системы свертывания крови - у большинства онкологических больных свертываемость крови повышена. Необходимо подчеркнуть, что факторы свертывающей и противосвертывающей систем крови могут способствовать инвазии опухолевых клеток в окружающие ткани, возникновению и стимуляции роста метастазов.
Продукты распада опухоли вызывают системную неспецифическую реакцию, заключающуюся в общей интоксикации организма, лихорадке. Продуцируемые злокачественными новообразованиями эктопические гормоны, нейромедиаторы, факторы роста могут влиять на клиническое течение и прогноз опухолевого процесса, а также использоваться в дифференциальной диагностике заболеваний.
Опухолевые маркеры
Начало изучения опухолевых маркеров было весьма обнадеживающим. Уже в конце XIX в. в моче больных множественной миеломой были обнаружены специфические белки (иммуноглобулины), получившие название «белки Бенс-Джонса», однако следующего успеха пришлось ждать более 80 лет. Он связан с открытием Г.И. Абелевым и Ю.С. Татариновым α-фетопротеина в крови больных гепатомой. Эти исследования положили начало новому этапу в изучении факторов, ассоциированных с ростом злокачественных опухолей, и привели к открытию в ХХ столетии серии различных соединений, получивших название «опухолевые маркеры».Маркеры широко используются клиническими биохимиками для выявления первичной опухоли и ее метастазов. К маркерам злокачественного роста относят вещества различной природы. В их число входит более 200 соединений: антигены, гормоны, ферменты, гликопротеины, липиды, белки, метаболиты, концентрация которых коррелирует с массой опухоли, ее пролиферативной активностью, а в некоторых случаях - со степенью злокачественности новообразования. Аномальная экспрессия генома - один из основных механизмов продукции маркеров опухолевыми клетка-
ми, который обусловливает синтез эмбриональных, плацентарных и эктопических белков, ферментов, антигенов и гормонов.
В качестве «идеальных тестов» для ранней диагностики злокачественных опухолей предлагалось множество маркеров, однако эта проблема до настоящего времени остается нерешенной. Сложности обусловлены многообразием требований, предъявляемых к «идеальному маркеру». Идеальный опухолевый маркер должен продуцироваться опухолевой клеткой в достаточных количествах, чтобы его можно было определить с помощью современных методов. Он не должен присутствовать у здоровых людей и при доброкачественных опухолях, но должен выявляться на ранних стадиях опухолевого процесса еще до клинических проявлений опухоли. Количество опухолевого маркера должно быть прямо пропорционально объему опухоли, а его уровень должен коррелировать с результатами противоопухолевого лечения.
В клинических исследованиях используется ряд достаточно эффективных «опухолевых маркеров», которые, однако, не всегда соответствуют всем вышеуказанным критериям в полной мере. Современные биохимические и иммунологические методы позволяют выявить новообразования, когда число опухолевых клеток достигает 109-1010, а минимальный уровень секретируемого опухолью маркера - от одного до нескольких фемтомолей в 1,0 мл сыворотки крови. Большая эффективность использования опухолевых маркеров в клинике может быть достигнута путем комбинации разных тестов. Следует отметить, что количество предлагаемых маркеров для диагностики и мониторинга злокачественных новообразований постоянно увеличивается, и наступает этап критической их переоценки с целью формирования стратегии и адекватного использования. Большинство опухолевых маркеров в достаточной степени изучено (см. табл. 13-4, 13-5). Из числа недавних успехов клинической биохимии следует отметить разработку и внедрение в практическую онкологию маркеров костного ремоделирования (пиридинолина, дезоксипиридинолина), поскольку кости скелета относятся к одной из наиболее распространенных локализаций метастазирования злокачественных опухолей. Биохимические методы диагностики метастазов в кости необходимы для правильного планирования лечебных мероприятий, определения стадии основного заболевания и оценки прогноза.
Таблица 13-4.Маркеры злокачественного роста

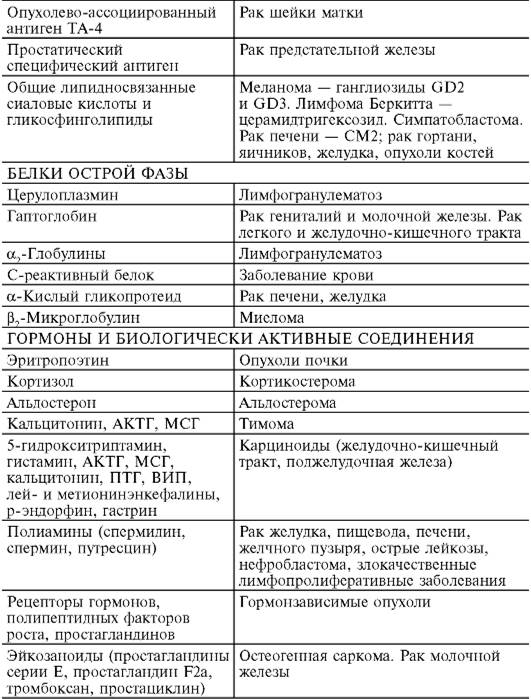
 Примечание. Здесь и в табл. 13-5: АКТГ - аденокортикотропный гормон; ВИП - вазоактивный интестинальный пептид; ЛДГ - лактатдегидрогеназа; МСГ - меланоцитстимулирующий гормон; ПТГ - паратиреоидный гормон; ЩФ - щелочная фосфатаза.
Примечание. Здесь и в табл. 13-5: АКТГ - аденокортикотропный гормон; ВИП - вазоактивный интестинальный пептид; ЛДГ - лактатдегидрогеназа; МСГ - меланоцитстимулирующий гормон; ПТГ - паратиреоидный гормон; ЩФ - щелочная фосфатаза.
Таблица 13-5.Гормоны, секретируемые опухолями, и вызываемые ими синдромы
| Секретируемый гормон | Клинический синдром | Локализация, вид опухоли |
| Кортикотропин (АКТГ) | Синдром Иценко- Кушинга | Аденомы гипофиза, опухоли надпочечников |
| β-Эндорфин | Аденомы гипофиза, феохромоцитомы надпочечников |
Продолжение табл. 13-5
| Энкефалины | Аденомы гипофиза, феохромоцитомы надпочечников | |
| Катехоламины и их метаболиты | Феохромоцитомы надпочечников. Хемодектома, ганглионейрома, нейробластома | |
| Инсулин | Гипогликемия | Инсулиномы поджелудочной железы |
| Глюкагон | Гипергликемия | Глюкагономы поджелудочной железы |
| Панкреатический полипептид (ПП) | Опухоли поджелудочной железы | |
| ВИП | Синдром «водной диареи» | ВИПы поджелудочной железы |
| Соматостатин | Соматостатиномы поджелудочной железы | |
| Кальцитонин | Медуллярные карциномы щитовидной железы | |
| КТ, гастрин, ВИП, инсулин, ПП | Синдром Вермера | МЭН-I: опухоли гипофиза, поджелудочной и паращитовидных желез |
| КТ, катехоламины, ПТГ | Синдром Сиппла | МЭН-II: медуллярный рак щитовидной и паращитовидной желез, феохромоцитомы надпочечников |
| ОПУХОЛИ ЭНДОКРИННЫХ ЖЕЛЕЗ НЕ ИЗ КЛЕТОК APUD- СИСТЕМЫ | ||
| Гормон роста | Гигантизмакромегалия | Аденомы гипофиза |
| Пролактин | Аменорея-галакторея | Пролактиномы гипофиза |
| Тиреотропин | Гипертиреоидизм | Аденомы гипофиза |
| ЛГ | Аденомы гипофиза | |
| ФСГ | Аденомы гипофиза | |
| ПТГ | Опухоли паращитовидных желез | |
| Хорионический гонадотропин | Трофобластические опухоли |
Окончание табл. 13-5
| АКТГ, β-эндорфин, энкефалины, β-ЛПТ, α-МСГ | Опухоли легкого, яичника, щитовидной, молочной, паращитовидных, поджелудочной желез, желудочно-кишечного тракта, пищевода, тимомы, параганглиомы надпочечников | |
| Кортикотропинрилизинг-фактор | Опухоли легкого, яичника | |
| Кальцитонин | Опухоли легкого, молочной и поджелудочной желез, почек, желудочнокишечного тракта | |
| Инсулин | Гипогликемия | Опухоли легкого, почек, молочной железы, шейки матки |
| Вазопрессин | Опухоли легкого, вилочковой железы, яичка, желчного пузыря | |
| Глюкагон | Гипергликемия | Опухоли почек, яичников, легкого |
| ВИП | Синдром «водной диареи» | ВИПы желудочнокишечного тракта, эпидермиса, феохромоцитомы надпочечников |
Примечание. ЛГ - лютеинизирующий гормон, ЛПТ - липотрофин, ФСГ - фолликулостимулирующий гормон.
Раковая кахексия
Термин «кахексия» (от греч. kakos - плохой и hexis - состояние) обозначает состояние общего истощения организма, потери массы тела за счет мышечной и жировой ткани и встречается при различных заболеваниях. У онкологических больных кахексия характеризуется анорексией, отвращением к пище, снижением массы тела, анемией, мышечной слабостью, при этом наблюдается интенсивный распад жиров и белков в организме, в результате чего наступает смерть.
Растущая в организме опухоль затрагивает многие стороны деятельности организма, оказывает существенное влияние на различ-
ные его функции. Для интенсивных синтетических процессов в ходе пролиферации опухолью потребляется огромное количество энергии, которую она получает за счет гликолиза, определяющего большой расход глюкозы. Общеизвестно, что опухоль - «ловушка глюкозы» (рис. 13-9). Поэтому в организме возникает угроза гипогликемии, что сопровождается активацией компенсаторно-
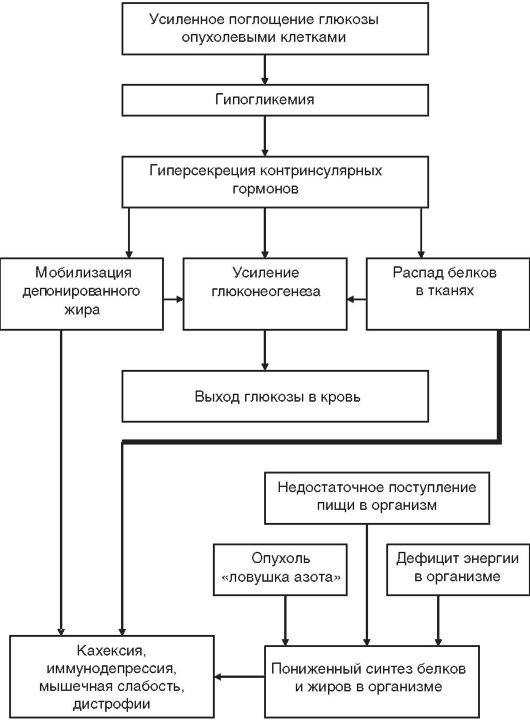 Рис. 13-9.Патогенез раковой кахексии
Рис. 13-9.Патогенез раковой кахексии
приспособительных механизмов. Усиливается продукция контринсулярных гормонов. Это приводит к усиленному распаду гликогена в печени и в мышцах, к распаду белков и жиров в тканях и органах организма для усиления процессов глюконеогенеза. Все это обеспечивает сохранение нормогликемии в течение достаточно длительного времени. Указанная компенсация так называемого «гипогликемического давления опухоли на организм» (по В.С. Шапоту) имеет нежелательные последствия для организма. Отмечается повышенный распад лимфоидной ткани, что сопровождается развитием иммунодефицитного состояния, тем более что процесс синтеза антител в организме при гипогликемии снижен. Кроме этого имеется повышенный распад мышечной ткани, в результате у больных развиваются дистрофические изменения в мышцах, мышечная слабость.
В организме-опухоленосителе ограничены возможности синтеза собственных белков и жиров, что усугубляет дистрофию тканей (мышечной, лимфоидной и др.) и кахексию. Это объясняется энергодефицитом (из-за гипогликемии), использованием метаболитов (аминокислот) для глюконеогенеза и снижением поступления питательных веществ в организм из-за анорексии, возникающей у онкологических больных.
Многие биологически активные вещества, выделяемые опухолями и нормальными клетками организма, способны влиять на развитие кахексии при онкологической патологии. К ним относятся цитокины, неконтролируемое выделение которых может быть одной из причин изменения обмена веществ в организмеопухоленосителе. Высказываются предположения о том, что TNF-α, IL-6 и γ-интерферон, повышенная экспрессия которых часто определяется при кахексии, могут выступать в качестве медиаторов этого процесса, способствуя развитию интоксикации, анорексии, снижению массы тела. При кахексии перечисленные цитокины определяются в повышенном количестве не только в опухоли, но и в циркулирующих жидкостях, а при снижении их содержания возможно обратное развитие кахексии.
В развитии кахексии, вызванной онкологической патологией, определенную роль может играть фактор мобилизации липидов, который осуществляет прямой гидролиз триглицеридов в жировой ткани до глицерина и неэстерифицированных жирных кислот. Введение сыворотки крови мышей с лимфомой здоровым особям вызывало массивную мобилизацию жиров. Фактор мобилизации
липидов присутствовал и в опухолевой ткани, и в культуре клеток лимфомы. Дальнейшие исследования показали, что это стабильный протеин с молекулярной массой около 5 кД, состоящий из двух субъединиц с высокой и низкой молекулярной массой. Он термостабилен, не реагирует на воздействие липазы, разрушается трипсином c образованием низкомолекулярной субъединицы, резистентной к воздействию протеолитических ферментов. Позже фактор мобилизации липидов был назван токсогормоном L. Его определили в асцитической жидкости больных гепатомой и у мышей с саркомой-180. Соединение с аналогичными характеристиками присутствовало в сыворотке крови больных с клиническими проявлениями онкологической кахексии и отсутствовало у здоровых пациентов. Оно также не было обнаружено у больных со значительным снижением массы тела при болезни Альцгеймера. Содержание фактора мобилизации липидов в сыворотке крови больных злокачественными опухолями коррелировало со снижением массы тела, а при эффективном лечении уровень определяемого фактора снижался.
Несмотря на большое число исследований по изучению механизмов развития кахексии при раке, медиатор этого состояния до настоящего времени не выявлен. На первый взгляд кахексия представляется невыгодным состоянием для опухоли, так как смерть организма ведет и к умиранию опухоли. Однако рост новообразования сильно зависит от экзогенного поступления липидов и аминокислот, поэтому выработка опухолью факторов, способствующих процессам катаболизма тканей, необходима для повышения метаболизма в ней самой. В этом случае ингибиторы кахексии при раке с помощью отграничения опухоли от главного энергетического материала, вероятно, могут вызвать снижение опухолевого роста. Все полученные результаты и высказанные исследователями предположения, возможно, помогут разработать новые подходы к лечению опухолей.
Дата добавления: 2016-07-11; просмотров: 3808;











