Жирорастворимые витамины Витамины группы А
Термин «витамин А» (антиксерофтальмический фактор) объединяет группу близких по химической структуре соединений: ретинола, ретиналя, ретиноевой кислоты, их эфиров.
Характерными симптомами недостаточности витамина Ау человека и животных являются специфические поражения глаз, кожи, слизистых оболочек, торможение роста, снижение массы тела, общее истощение организма. Поражение эпителия кожи проявляется его ускоренной пролиферацией и патологическим ороговением, что сопровождается развитием фолликулярного папулезного гиперкератоза («жабья кожа»). Нарушение эпителизации вызывает сухость кожи, шелушение, развитие вторичных инфекций. При авитаминозе А поражается эпителий слизистой оболочки мочеполовой и дыхательной систем, а также пищеварительного тракта, что вызывает (усугубляет) нарушение всасывания жирорастворимых витаминов. Снижение барьерной функции кожи и слизистых оболочек способствует проникновению в организм болезнетворных микробов и возникновению дерматитов, ларинготрахеобронхитов, пневмоний, циститов, пиелитов и т.д. Ороговение эпителия слезного канала приводит к его закупорке, развитию сухости конъюнктивы и роговой оболочки глаза (ксерофтальмия)с последующим конъюнктивитом, отеком, изъязвлением и размягчением роговицы (кератомаляция),так как глазное яблоко не омывается слезной жидкостью, обладающей бактерицидными свойствами. Может развиться атрофия слезных желез. На склерах образуются очаги гиперкератоза (бляшки Бито). Исходом кератомаляции может быть помутнение роговицы (бельмо), приводящее к слепоте (амблиопия).Специфическим симптомом авитаминоза (гиповитаминоза) А является куриная, или сумеречная, слепота (гемералопия).Недостаточность витамина А проявляется прежде всего нарушением темновой адаптации - увеличением промежутка времени, необходимого для адаптации после перехода из освещенного помещения в темное. Наряду с этим увеличивается зрительный порог, т.е. минимальная интенсивность света, которая вызывает зрительные ощущения.
Витамин А обладает широким спектром биологического действия. Он участвует в процессах фоторецепции, необходим для роста тела, воспроизведения потомства, поддержания иммуно-
логического и гематологического статуса, пролиферации и дифференцировки тканей (эпителии кожных покровов, слизистых, сперматогенный эпителий, костная ткань); влияет на многие стороны обмена веществ: тканевое дыхание и энергетический обмен в тканях (стабилизирует митохондриальные мембраны и активирует синтез убихинона), обмен белков (воздействует на инициацию репликации), углеводов (участвует в синтезе мембранных гликопротеинов и гликолипидов), липидов (влияет на превращение мевалоновой кислоты в холестерин), нуклеиновых кислот. Большинство метаболических эффектов витамина А связано с его влиянием на стабильность и проницаемость клеточных мембран.
Развитие гемералопии при гиповитаминозе А связано с участием витамина в фотохимическом акте зрения. Светочувствительным пигментом сетчатки (палочек) является сложный белок родопсин, состоящий из липопротеина опсина и простетической группы, представленной 11-цис-ретиналем (рис. 12-5). На свету родопсин расщепляется на опсин и ретиналь, последний подвергается превращению в трансформу. Фотоизомеризация ретиналя вызывает местную деполяризацию мембраны, что приводит к возникновению электрического импульса, который распространяется по нервному волокну. Цикл превращений светочувствительного пигмента завершается в темноте регенерацией родопсина (соединением опсина и 11-цис-ретиналя, который может синтезироваться из цис-ретинола или транс-ретиналя) и восстановлением чувствительности к свету слабой интенсивности. Потери ретиналя в цикле должны восполняться за счет поступления в организм ретинола с пищей. При дефиците витамина А нарушается темновая фаза цикла - восстановление родопсина. Развивается дегенерация наружных сегментов палочек.
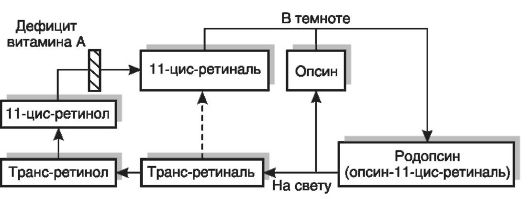 Рис. 12-5.Механизм нарушения сумеречного зрения при гиповитаминозе А
Рис. 12-5.Механизм нарушения сумеречного зрения при гиповитаминозе А
Глубокий дефицит витамина А может оказывать влияние на цветоощущение, так как он входит и в состав йодопсинов (светочувствительных пигментов колбочек, отвечающих за цветовое зрение). Дефицит витамина А обусловливает нарушение синтеза хондроитинсульфатов, влияющее на формирование соединительной ткани, в том числе костной, из-за увеличения распада фосфоаденозинфосфосульфата под действием лизосомальных сульфатаз, подавляемых ретиноидами.
В условиях гиповитаминоза А замедляется синтез гликопротеинов, нарушаются рецепторный состав клеточных поверхностей, выработка гормонов, секретов, разрыхляется гликокаликс, нарушается структура межклеточного вещества, снижаются адгезивные свойства клеток. В клетках тормозится синтез РНК, падает активность ферментов, обеспечивающих защиту липидов от окисления. При недостатке витамина А вследствие нехватки ростовых факторов и медиаторов задерживается пролиферация эпителиальных и мезенхимных клеточных популяций, возможно, активируется апоптоз. Развивается функциональная неполноценность железистых эпителиев с их метаплазией. Страдает иммунитет, сперматогенез прекращается на стадии мейоза.
Дефицит витамина А ведет к нарушению противосвертывающих механизмов крови (рост толерантности плазмы к гепарину, гиперфибриногенемия).
У новорожденных практически нет запасов витамина А, поэтому при отсутствии его в рационе питания быстро развивается авитаминоз с соответствующим симптомокомплексом, вплоть до летального исхода.
Вторичный гиповитаминоз Авозможен при печеночной недостаточности, так как в клетках печени ретинолэстераза освобождает ретинол, который транспортируется в крови в связанном с белком состоянии; при протеинурии - вследствие потери ретинолсвязывающего белка; при алкоголизме - вследствие недостатка цинка и ниацина, необходимых для метаболизма витамина А, а также нарушения всасывания ретинола из-за алкогольной мальабсорбции. Нарушение превращения провитаминов в витамин А с развитием каротинемической псевдожелтухи может возникать при гипотиреозе, так как активность β-каротиндиоксигеназы (фермента, превращающего β-каротин в ретиналь) стимулируется гормонами щитовидной железы.
Недостаточность витамина А может развиваться при врожденном нарушении превращения β-каротина в ретиналь, связанном с генетическим дефектом β-каротиндиоксигеназы.
Генетический дефект, при котором увеличивается потребность в витамине А для поддержания нормального состояния эпителиальной ткани, лежит в основе фолликулярного кератоза Дарье. Наряду с изменениями кожи и слизистой оболочки полости рта у больных с данной патологией отмечаются отставание умственного развития и психозы.
Поступление в организм больших доз витамина А, во много раз превышающих физиологическую потребность, вызывает характерную картину интоксикации, известную под названием гипервитаминоз А.В клинической картине острой формы отравления у животных, часто заканчивающейся смертью, преобладают судороги и параличи. Хроническая форма характеризуется остановкой роста, потерей массы тела, спонтанными переломами длинных трубчатых костей (вследствие торможения остеогенеза и активации хондролитических процессов), кровоизлияниями во внутренние органы, дегенеративными изменениями эндокринных желез, печени, селезенки.
Гипервитаминоз А у человека может возникнуть в результате употребления продуктов, содержащих большое количество витамина А, либо токсических доз препаратов витамина А (50 тыс. МЕ в сутки при продолжительном применении или 1-6 млн МЕ однократно). Острый гипервитаминоз А чаще всего выражается в головокружении, тяжелой головной боли, сонливости, ступоре, диспепсических явлениях (понос, рвота), шелушении кожи. Хроническое отравление витамином А влечет за собой головную боль, сухой дерматит, выпадение волос, боль в суставах и костях при ходьбе и надавливании, отек вдоль трубчатых костей, повышенную ломкость костей, кальциноз связок, анорексию, потерю массы тела, гепатоспленомегалию, геморрагический синдром. Нередко наблюдаются симптомы экзофтальмии и повышения давления спинно-мозговой жидкости, отек соска зрительного нерва, связанный с развитием ликворной гипертензии и сдавлением нервов в отверстиях костей черепа. Высокие дозы витамина А эмбриотоксичны. На фоне гипервитаминоза А наряду с активацией фибринолиза (ретинол стимулирует продукцию активатора плазминогена клетками эндотелия), сопровождаемой гипофибриногенемией, проявляется рост антитромбиновой активности.
При гипервитаминозе А в клетках нарушаются окислительно-восстановительные реакции, ускоряются процессы гликозилирования; в липидном слое мембран, изменяющих свои физико-химические свойства, появляются участки, обогащенные витамином А, гипертрофируется комплекс Гольджи, разрушаются мембраны митохондрий, цитоплазматического ретикулума, нарушается структура гликокаликса и межклеточных контактов. Клетки разобщаются, усиливается фагоцитоз. Развиваются слизистая метаплазия ороговевающих эпителиев, нарушение зрения, генерализованное аутоиммунное воспаление, дегенеративные изменения многих органов и систем (некроз гепатоцитов и клеток почечного канальцевого эпителия, фиброз печени).
Как гипо-, так и гипервитаминоз А сопровождаются активацией свободнорадикальных процессов, поскольку ретинол в гидрофобной области мембран клеток выполняет роль стерического регулятора, определяющего доступность ненасыщенных жирных кислот, которые входят в состав фосфолипидов, для окисления.
Витамин А содержится в основном в продуктах животного происхождения (печень, цельное молоко, сливки, сметана, сливочное масло, сыр). Особенно богаты им печень и внутренний жир некоторых видов рыб (палтус, треска) и морского зверя (киты, моржи, тюлени, дельфины), белого медведя. Основным пищевым источником каротинов (провитаминов А) являются продукты растительного происхождения: морковь, красный перец, томаты, зелень петрушки, салат, шпинат, щавель, облепиха, шиповник и др. Суточная потребность в витамине А для взрослого человека - 1,5-3,0 мг, или 2-5 мг β-каротина; для детей выше, чем для взрослых. Повышается при беременности, лактации, утомлении, продолжительном напряжении зрения.
Витамины группы D
Витамин D (кальциферол) - антирахитический фактор, его открытие связано с поисками лечебного препарата для профилактики и лечения рахита. Основным источником витамина D является эндогенный синтез: до 80% необходимого количества витамина D3 (холекальциферола) организм может синтезировать в коже (в макрофагальных клетках дермы) под воздействием ультрафиолетовых лучей из 7-дегидрохолестерина (провитамина D3). В растениях и дрожжах содержится эргостерин (провитамин D2) - предшественник эргокальциферола (витамина D2).
Дефицит кальциферола,часто проявляющийся у людей в современных условиях, неразрывно связан с образом жизни значительной части населения - скоплением людей в больших городах, сокращением времени пребывания на свежем воздухе. Уменьшение содержания витамина D в организме наблюдается при недостаточном поступлении его с продуктами питания при одновременном снижении эндогенного синтеза. Велика вероятность развития гиповитаминоза D у недоношенных детей, так как женское молоко содержит недостаточное его количество, а через плаценту витамин поступает в основном в последнем триместре беременности. Эндогенный гипо- и авитаминоз D может возникать при нарушении переваривания и (или) всасывания липидов, в том числе жирорастворимых витаминов (механическая желтуха, холестаз, панкреатическая недостаточность); нарушении образования активных форм витамина: гидроксилирования в печени (при циррозе) и в почках (при хронической почечной недостаточности); усилении распада (например, под влиянием ряда лекарственных препаратов, индуцирующих активность ферментов системы микросомального окисления).
Уменьшение синтезаи/или поступления витамина D с пищей, нарушения метаболизма холекальциферолавызывают «кальципенический» рахит у детейи остеомаляцию у взрослых.Нарушения кальций-фосфорного обмена, играющие главную роль в патогенезе рахита, приводят к нарушению минерализации костной ткани, особенно в зонах роста трубчатых и черепных костей. Помимо нарушения минерализации остеоида, при рахите наблюдаются усиленное рассасывание костной ткани, вымывание кальция и фосфата из кости, что обусловлено гиперсекрецией паратгормона (развитие вторичного гиперпаратиреоза), стимулируемой низким уровнем кальция в крови. Ухудшение энергообеспечения процессов костеобразования и минерализации костной ткани связано с нарушением всасывания и метаболизма цитрата при недостатке витамина D. Рахитические кости медленнее растут, не способны выдерживать нормальную статическую и динамическую нагрузки, легко подвергаются механическим деформациям, что обусловливает внешние проявления рахита со стороны скелета: искривление нижних конечностей, рук и позвоночника, утолщение эпифизов длинных трубчатых костей («рахитические браслеты»), «рахитические четки» на грудных концах ребер, «куриная грудь» с выступающей грудиной и сдавленными с боков ребрами, задержка
закрытия родничков и прорезывания зубов, «лоб Сократа» (периостальные наслоения остеоида в области лобных и теменных бугров), краниотабес (уплощение затылочных костей) (рис. 12-6, 12-7). К ранним клиническим проявлениям рахита относятся раздражительность, мышечная гипотония (связанная не только с изменением нервной регуляции, но и с нарушением структуры и метаболизма мышечных волокон), тетания (в связи с системной гипокальциемией), облысение затылка, развитие бронхолегочных заболеваний, связанное с ухудшением вентиляции легких и снижением иммунитета.
Недостаток витамина Dу взрослых вызывает нарушение периостального окостенения (остеоид вырабатывается, но не минерализуется) - развивается остеомаляция. У больных отмечаются гипоцитратемия, гипофосфатемия, в тяжелых случаях - гипо-
кальциемия, развивается гиперпаратиреоз. При развитии злокачественных новообразований остеомаляция может быть связана с торможением образования кальцитриола в почках пептидными факторами, синтезированными в опухолевых тканях.
Физиологически активной формой является не сам витамин D, а его метаболиты (в настоящее время их известно более 40: 25-ОНD3, 1а,25-(ОН)2D3, 24,25-(ОН)2D3, 25,26-(ОН)2D3, 1,24,25-(ОН.уЭ3 и др.), образующиеся в результате обменных превращений в тканях. Образование кальцитриола (1,25-дигидроксихолекальциферол [1,25-(ОН)2D3]), поддерживающего уровень кальция и фосфора в сыворотке крови в узких физиологических границах, происходит в организме в несколько этапов. Фотохимически синтезированный в коже витамин D3 под воздействием гидроксилаз подвергается двум реакциям гидроксилирования: сначала в печени в 25-м положении (25-гидроксилаза), затем в почках в 1-м положении (1а-гидроксилаза) (рис. 12-8). Образование активной формы витамина D3 в почках контролируется через систему обратных связей с обменом Са, Р, секрецией паратиреоидного гормона, кальцитонина, соматостатина, пролактина, половых гормонов и инсулина. Избыток 1,25-(ОН)2D3 в организме ингибирует его образование.
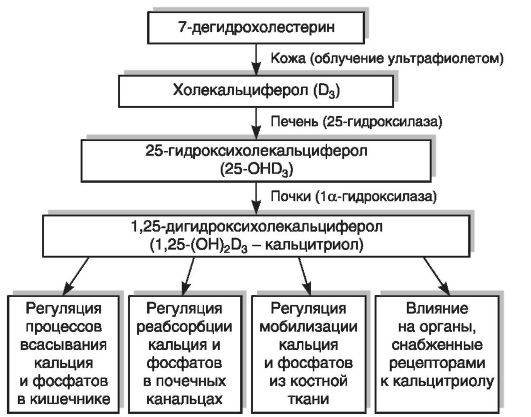 Рис. 12-8.Метаболизм и функции витамина D3
Рис. 12-8.Метаболизм и функции витамина D3
Дефицит витамина D ведет к понижению концентрации кальция и фосфора в сыворотке крови и нарушениям деятельности многих систем организма: нервной, мышечной, костной, репродуктивной, иммунной. Регулирующий эффект витамина D в отношении кальций-фосфорного обмена достигается за счет воздействия кальцитриола на следующие процессы: реабсорбцию кальция и фосфатов в почечных канальцах, мобилизацию элементов из костной ткани, всасывание Са2+ и фосфатов в кишечнике (наиболее весомый вклад в антирахитическое действие). В клетках кишечника под влиянием кальцитриола происходит синтез Сасвязывающего белка (кальбиндин, или холекальцин) и стимуляция транспорта Са2+. Остеогенез и ремоделирование костной ткани регулируются 24,25-(ОН)2D3. Рецепторы к 1,25-(ОН)2D3 обнаружены, помимо органов-мишеней (кишечник, костная ткань, почки), и в ряде других органов и тканей: в коже, мозгу, гипофизе, половых, молочных, паращитовидных железах и др. Биологические эффекты кальцитриола реализуются через взаимодействие его с рецепторами в ядре клеток, следствием чего является избирательная стимуляция процесса транскрипции ДНК, приводящая к синтезу молекул матричной РНК и трансляции кальцийсвязывающих белков и гормонов, регулирующих обмен Са2+. Витамин D не только влияет на процессы, непосредственно связанные с минеральным обменом, но также регулирует пролиферацию и дифференцировку различных типов клеток, в том числе клеток иммунной системы (макрофаги, Т- и В-лимфоциты). Активированные цитокинами макрофаги могут синтезировать кальцитриол, который усиливает их способность к завершению фагоцитоза.
Избыток витамина D, к которому особенно чувствительны дети, оказывает токсическое действие на организм. К наиболее вероятным причинам гипервитаминоза Dотносятся: продолжительная передозировка или однократный прием токсической дозы витамина, активация почечного (при первичном гиперпаратиреозе) и внепочечного синтеза 1,25-(ОН)2D3 (в цитокинактивированных макрофагах при саркоидозе). Гипервитаминоз D проявляется глубокими нарушениями гомеостаза Са2+ и фосфатов, которые не способны корректироваться нейрогуморальными системами организма. При избытке витамина D развивается усиленная резорбция костной ткани, которая не сопровождается соответствующей реутилизацией минеральных веществ, так как подавлены процесс образования кости и ее минерализация. Это не связано с влия-
нием паратиреоидного гормона (при гипервитаминозе активность паращитовидных желез снижена). Остеопения, которая развивается в этих условиях, является результатом торможения дифференцировки хондроцитов, дефицита остеобластов и остеонекроза, приводящего к дезинтеграции комплекса органического матрикса и минерального компонента. Развиваются гиперкальциемия, гиперкальциурия, отмечаются отложения труднорастворимых солей (почечные конкременты, кальцификация почек, а также кровеносных сосудов, печени, легких, сердечной мышцы, стенок кишечника, приводящая к тяжелому и стойкому нарушению функций этих органов), снижение активности щитовидной железы и гонад, мышечная ригидность, гипертензия. Наблюдаются также неспецифические симптомы отравления: тошнота, диарея, потеря аппетита, головная боль, слабость. У детей гипервитаминоз D вызывает раннее зарастание родничков (с возможным формированием микроцефалии), прекращение роста скелета в длину, утолщение диафизов и эпифизов. Летальный исход при тяжелом гипервитаминозе D может быть вызван почечной недостаточностью, сдавлением мозга, ацидозом и гиперкальциемическими аритмиями.
В эксперименте показано, что избыток витамина D и его метаболитов может оказывать прямое повреждающее действие на мембраны клеток, усиливая в них процессы перекисного окисления липидов.
К наследственным нарушениям обмена и функций витамина D относятся витамин D-зависимый наследственный рахит I типа (дефект почечной 1а-гидроксилазы) и витамин D-зависимый наследственный рахит II типа (дефект тканевых рецепторов кальцитриола).
Наибольшее количество витамина D3 содержится в продуктах животного происхождения - сливочном масле, желтке яиц, печени, рыбьем жире. Из растительных продуктов наиболее богаты витамином D2 растительные масла (подсолнечное, оливковое и др.). Суточная потребность в витамине D для взрослых - 10-25 мкг.
Витамины группы Е
Важнейшие проявления недостаточности витаминов группы Е
(токоферолы, антистерильный фактор, витамин размножения) у экспериментальных животных (крысы, кролики, собаки, кошки и др.) - нарушения эмбриогенеза и дегенеративные изменения
репродуктивных органов, приводящие к стерильности. У самок процесс оплодотворения яйца не нарушен, но развивающиеся патологические изменения в матке, дегенерация эмбриональной сосудистой системы приводят к внутриутробной гибели плода. У самцов происходит атрофия семенников с дегенерацией сперматогенных клеток, приводящая к полной или частичной стерильности. Наряду с этим отмечаются дистрофия скелетных и гладких мышц, миокарда (фрагментация мышечных волокон, микронекрозы, деструкция митохондрий, нарушение образования креатинфосфата); гипотонус, резкое органичение подвижности животных; жировое перерождение печени; энцефаломаляция, демиелинизация и глиоз в спинном мозгу, атаксия, гипорефлексия, дизартрия, параличи конечностей.
Витамин Е депонируется в организме, поэтому признаки его недостаточности у человека обнаруживаются редко, за исключением населения тех стран, где растительные жиры (основные источники витамина в пище человека) почти не используются для питания. Уменьшение содержания витамина Е в сыворотке крови отмечается при недостаточности питания, нарушении всасывания (муковисцидоз, атрезия желчных протоков, стеаторея и др.), анемии при квашиоркоре, гемолитической анемии у недоношенных, абеталипопротеинемии, отравлении некоторыми химическими веществами (например, акронитрилом), лучевом поражении, ишемической болезни сердца, злокачественных новообразованиях, туберкулезе легких, неспецифических воспалительных процессах в легких, ожоговой болезни, язвенной болезни желудка и двенадцатиперстной кишки, проведении химиотерапии (стрептомицином, тубазидом).
Основная функция токоферолов, наиболее активных природных жирорастворимых антиоксидантов, - регуляция интенсивности свободнорадикальных реакций в клетках, выражающаяся в ограничении скорости процессов перекисного окисления ненасыщенных жирных кислот в липидах биологических мембран. Токоферолы являются синергистами селена как кофактора глутатионпероксидазы, участвующей в нейтрализации гидроперекисей липидов. Витамин Е защищает от перекисного окисления ненасыщенную боковую цепь витамина А, повышая его биологическую активность, восстанавливает коэнзим Q, принимающий участие в окислительном фосфорилировании, регулирует активность фосфолипазы А2, участвующей в метаболизме арахидоновой кислоты, - предшественницы простагландинов и лейкотриенов. Регуляцию
биосинтеза ферментов витамин Е осуществляет, возможно, на уровне транскрипции матричных РНК.
Витамин Е, являясь антиоксидантом, стабилизирует клеточные мембраны и обеспечивает нормальное течение биохимических процессов, поэтому недостаточное содержание токофероловв организме приводит к формированию различных проявлений так называемой мембранной патологии.Токоферолы реагируют с активными формами кислорода (гася центры инициации свободнорадикальных процессов), свободными радикалами ненасыщенных жирных кислот и их перекисями, обезвреживая их (обрывая уже инициированную цепную реакцию перекисного окисления липидов - ПОЛ или замедляя ее), свободными жирными кислотами, повышение содержания которых рассматривается как патогенетический механизм повреждения клеточных структур, в частности скелетных и сердечной мышц. Мембраностабилизирующее действие токоферолов обусловлено также их способностью предохранять от окисления SH-группы мембранных белков, в том числе ферментов, и образовывать в качестве структурного компонента мембран гидрофобные комплексы с ненасыщенными жирными кислотами, защищая мембраны от окисления.
Недостаточность токоферолов проявляется разнообразными симптомами, связанными со структурно-функциональными нарушениями мембран: гемолитическая анемия у недоношенных детей, атрофия семенников и бесплодие, рассасывание плода на ранних сроках беременности, мышечная дистрофия, развитие морфологических изменений в клетках паренхиматозных и эндокринных органов, сопровождающихся нарушением их функций (гибель клеток слизистой оболочки кишечника, появление участков некроза в печени, ткани мозга, особенно мозжечка, щитовидной железе и др.). При недостатке витамина Е наиболее выраженно повреждаются клетки быстро пролиферирующих тканей (зародышевые ткани, гемопоэтические клетки, сперматогенный эпителий, гепатоциты, слизистая оболочка кишечника, эндокринные органы), в которых осуществляется интенсивный мембраногенез, сопровождающийся снижением антиоксидантных резервов, а также клетки, в которых интенсивно образуются активные формы кислорода (нейроны и миоциты). Непосредственная причина мышечной дистрофии - высвобождение лизосомальных гидролаз, связанное, возможно, с нарушением обмена полиненасыщенных жирных кислот в лизосомальных мембранах.
Недостаток витамина Е сопровождается снижением содержания иммуноглобулина Е и количества Т- и В-лимфоцитов в периферической крови. Токоферолы участвуют в синтезе нуклеиновых кислот, гема микросомальных цитохромов и других гемсодержащих белков. При недостаточности витамина Е происходит снижение интенсивности тканевого дыхания, что объясняется влиянием а-токоферола на синтез убихинона и его участием в предохранении сульфгидрильных групп белков от окисления. При дефиците витамина Е снижается активность ферментных систем, функционально связанных с мембранами клеток, содержание в тканях креатинфосфата и АТФ. Дефицит токоферолов сопровождается нарушением образования тромбоксанов и простациклинов (за счет торможения накапливающимися перекисями активности простагландинсинтазы).
Гиповитаминоз Е возможен при наследственной абеталипопротеинемии в связи с нарушением транспорта витамина.
Симптомы гипервитаминоза Еу животных сходны с симптомами гиповитаминоза Е (поражение скелетных мышц, семенников, размягчение мозга). Ранние признаки интоксикации витамином Е у человека - резкое повышение содержания его в сыворотке крови и преходящая креатинурия. При значительной передозировке витамина наблюдаются замедление активации протромбиназы, тромбоцитопатии, гипокоагуляция, геморрагии, гипогликемия, диспепсия, головная боль, слабость, повышенная мышечная утомляемость, мышечные судороги. Избыток токоферолов может активировать ПОЛ, эти соединения способны образовывать свободные радикалы.
Источниками витамина Е для человека являются растительные масла (подсолнечное, хлопковое, кукурузное и др.), а также салат, капуста и семена злаков; из продуктов животного происхождения витамин Е содержится в мясе, сливочном масле, яичном желтке и др. Суточная потребность в витамине Е составляет около 5 мг.
Витамины группы К
К витаминам группы К (нафтохиноны, антигеморрагический фактор) относятся витамины К1 (филлохинон) и К2 (менахинон). Активные метаболиты нафтохинонов, возможно, представляют собой их гидрохиноновые производные.
Авитаминоз Ку человека встречается нечасто, смешанная пища довольно богата витамином, который, кроме того, синтезируется микрофлорой кишечника. Витамин К-дефицитные состояния могут быть вызваны подавлением кишечной микрофлоры антибиотиками и сульфаниламидами, недостаточным поступлением витамина с пищей, нарушением всасывания жиров, в том числе жирорастворимых витаминов (энтерит, недостаток желчи при циррозе, механической желтухе), а также нерациональным лечением тромбозов и эмболий антикоагулянтами кумаринового ряда, являющимися антивитаминами К.
К-витаминная недостаточность проявляется снижением содержания в крови активных факторов свертывания крови II (протромбин), VII (проконвертин), IX (фактор Кристмаса) и Х (фактор Стюарта-Прауэра), вследствие чего удлиняется время свертывания крови, тромбопластиновое и протромбиновое время, снижается протромбиновый индекс, в плазме накапливаются некарбоксилированные предшественники факторов свертывания. При снижении протромбинового индекса ниже 35% развиваются геморрагические явления вплоть до обильных кровотечений, в первую очередь в областях тела, подвергшихся травмам (операционные раны, ушибы, гематомы в области пункции вен и т.п.), а также самопроизвольные паренхиматозные и капиллярные кровотечения. При более глубокой гипопротромбинемии развивается тяжелый геморрагический диатез с гематурией, наличием крови в рвотных массах, гематомами в различных областях тела, гемартрозом и т.д. Недостаточность витамина К у недоношенных детей, особенно подвергшихся асфиксии в родах, проявляется кровоизлияниями в желудочно-кишечном тракте, меленой, носовыми и нёбными кровотечениями, кровотечениями из культи пуповины. Без лечения погибает около 30% заболевших. При летальных исходах обнаруживают кровоизлияния в надпочечниках, печени, мозгу, легких и других органах. Низкое содержание витамин К-зависимых факторов свертывания у новорожденных связано с отсутствием в первую неделю жизни в кишечнике микрофлоры, небольшим запасом витамина в печени и недостаточным содержанием витамина К в женском молоке.
Витамин К принимает участие в посттрансляционной модификации в печени белков, участвующих в сложном процессе свертывания крови: факторов II, VII, IX и X, что обеспечивает их физиологическую активность, а также влияет на состояние эн-
дотелия кровеносных сосудов. Посттрансляционная модификация белков свертывания крови, требующая наличия витамина К, заключается в γ-карбоксилировании остатков глутаминовой кислоты в их молекулах при участии γ-глутамилкарбоксилазы. Витамин К функционирует в качестве кофактора карбоксилирования. Предположительно его роль сводится либо к транспорту НСО3-, включающихся в γ-положение остатков глутаминовой кислоты, либо к активации водорода γ-углеродного атома глутаминовой кислоты, либо к активации γ-глутамилкарбоксилазы. Постсинтетическое карбоксилирование остатков глутаминовой кислоты необходимо для оптимального связывания факторами свертывания крови ионов Са2+, посредством которого осуществляется прикрепление белков к полианионным поверхностям, что дает им возможность выполнять прокоагулянтные функции. Витамин К участвует также в карбоксилировании неколлагеновых белков костей, почечных белков, антитромботических белков С и S. Витамин К необходим для кальцификации остеоидной матрицы. Витамин К-зависимые Са2+-связьгаающие белки участвуют в почечной реабсорбции Са2+. Дефицит витамина К может вызывать изменение агрегационной активности эритроцитов, связанное с дестабилизацией эритроцитарных мембран.
Повышенная дозировка витаминов К и К2вызывает у животных снижение концентрации гемоглобина и количества эритроцитов и в 1,5-2 раза повышает содержание протромбина в крови; у людей обнаружено преходящее повышение свертывания крови. Гемолиз эритроцитов связан с повышением содержания метгемоглобина. Передозировка витамина К у новорожденных (и особенно недоношенных) может вызвать гемолитическую анемию, гепатоцеллюлярное поражение и ядерную желтуху вследствие повышенного содержания билирубина в крови. Водорастворимые аналоги витамина К при передозировке вызывают гемолитическую анемию и поражение печени.
К растительным продуктам, богатым витамином К, относятся капуста, шпинат, салат, тыква, зеленые томаты, арахисовое масло, ягоды рябины и т.д. В животных продуктах, кроме печени свиньи, он почти нигде не содержится. Суточная потребность в витамине К точно не установлена, поскольку он синтезируется микроорганизмами кишечника (до 1,5 мг в сутки); считается достаточным количество 1 мг.
Дата добавления: 2016-07-11; просмотров: 2361;











