Реакции второго порядка
К таким реакциям принадлежат реакции, скорость реакции, скорость которых пропорциональна концентрация каждого из реагирующих веществ или квадрату концентрации одного из них:
A + B → продукты,
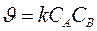 (1.13а)
(1.13а)
или, если CA = CB, то
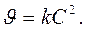 (1.13б)
(1.13б)
Пусть a и b – начальные концентрации C0 вещества A и B, а x – число молей в 1 л, которое прореагировало за время τ. Тогда
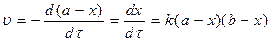 (1.14)
(1.14)
Если начальные концентрации веществ А и В одинаковы, т.е. a = b, тогда (1.14) превращается в
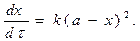 (1.15)
(1.15)
Уравнения (1.14) и (1.15) – дифференциальные уравнения скорости бимолекулярной реакции.
Разделим переменные:
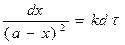 .
.
Интегрирование этого уравнения даёт:
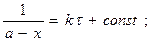 (1.16)
(1.16)
const определяется из начальных условий:
x = 0 при τ = 0,
тогда const = 1/a и
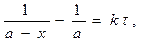 (1.17)
(1.17)
откуда
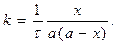 (1.18)
(1.18)
Уравнение (1.18) можно привести к другому простому виду. Подставляя C0 = a, a – x = C, x = C0 – C в (1.17), получим
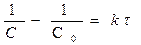 (1.19)
(1.19)
и
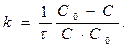 (1.20)
(1.20)
Напомним, что такой результат мы получим только в случае равенства начальных концентраций веществ А и В. Если начальные концентрации реагирующих веществ не равны, необходимо интегрировать уравнение (1.14).
Интегрирование по частям или методом неопределённых коэффициентов (1.14) приводит к более сложному выражению:
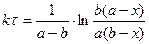 (1.21)
(1.21)
или
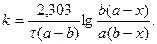 (1.22)
(1.22)
Период полураспада для реакции второго порядка найден из (1.20). Подставив C = ½ C0,
получим
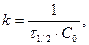
т.е.
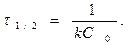 (1.23)
(1.23)
Для реакции второго порядка время полураспада обратно пропорционально начальной концентрации исходного вещества.
Дата добавления: 2020-07-18; просмотров: 175;










