Механизмы некоторых реакций, катализируемых металлами.
В механизмах гетерогенного катализа переходными металлами много общего с гомогенным катализом комплексами переходных металлов.
Рассмотрим некоторые простейшие реакции.
Гидрирование этилена на некоторых металлах протекает по следующему каталитическому циклу:
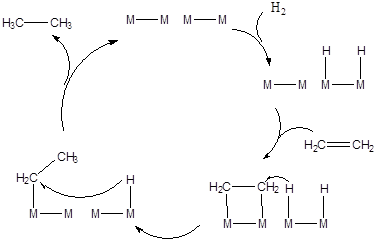 (5.33)
(5.33)
Вначале молекула водорода диссоциативно хемосорбируется на двух активных центрах (аналог реакции окислительного гомолитического присоединения). Затем ассоциативно, с разрывом p-связи и образованием двухцентрового комплекса, хемосорбируется молекула этилена. Далее хемосорбированный водород атакует один из атомов углерода с образованием -СН3 группы и освобождением двух активных центров поверхности металла (стадия аналогичная восстановительному элиминировнаию). То же самое происходит и со вторым атомом углерода. Образовавшийся этан десорбируется и каталитический цикл завершается.
Изомеризация (миграция двойной связи и пространственная изомеризация) при катализе металлами часто протекает по следующему механизму:
(5.34)

Процесс протекает в присутствии веществ (водород, вещества - доноры водорода), образующих хемосорбированный водород на поверхности катализатора. Олефин (в котором фрагменты R1CH2- и R2- находятся в цис-положении) образует p-комплекс с соседним атомом металла (одноцентровая молекулярная хемосорбция олефина). Затем водород атакует один из атомов углерода при двойной связи (реакция внедрения) и образуется s-алкильный поверхностный комплекс. В этом комплексе возможно вращение вокруг s-связей. В результате вращения на 120о вокруг связи С-С (продолжение каталитического цикло вправо на Рис. 5.34) к свободному активному центру поверхности приблизится атом водорода не тот, который вошел в молекулу на предыдущей стадии, а тот, который изначально был в составе молекулы. В результате последующего b-элиминирования этого водорода образуется олефин, пространственно изомерный исходному (фрагменты R1CH2- и R2- находятся в транс-положении). При повороте s-алкильного комплекса вокруг s-связи металл-С (продолжение каталитического цикло влево на Рис. 5.34) соседнему активному центру становится доступен атом водорода в фрагменте R1CH2-. В результате b-элиминирования этого атома водорода образуется олефин с переместившейся двойной связью.
Реакции гидрогенолиза часто протекают по механизму, характерному для реакции гидродехлорирования дихлоруксусной кислоты до монохлоруксусной, катализируемой палладием (Рис. 5.35).
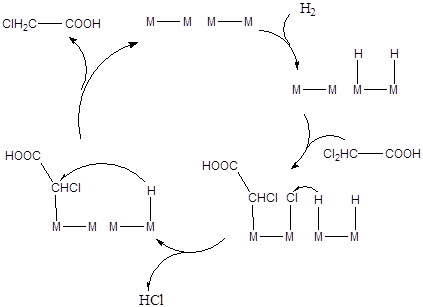 (5.35)
(5.35)
Полупроводники
Полупроводники - неметаллические твердые материалы, проводимость которых сильно увеличивается с повышением температуры.
Электронная структура полупроводников изучена лучше, чем у металлов. Для объяснения каталитических свойств полупроводников хорошо применима зонная модель, рассмотренная выше.
Чаще всего полупроводники образуют ионные кристаллические решетки. В идеальных кристаллах это приводит к тому, что в электронной структуре образуются две энергетические зоны: валентная зона, в которой все уровни заняты спаренными электронами с низкой энергией и зона проводимости, образованная незанятыми разрешенными уровнями и лежащая гораздо выше по энергии. Электроны, принадлежащие валентной зоне не обладают проводимостью. Таким образом в идеальном состоянии в полупроводниках нет подвижных электронов, способных проводить электрический ток.
Например (Рис. 5.40) в идеальном кристалле ZnO, валентная зона образуется 3d-электронами иона Zn2+ (3d104s0) и 2p-электронами иона О2- (2s22p6), а зона проводимости образуется не занятыми 4s-уровнями иона Zn2+ .
Согласно зонной модели в полупроводниках валентная зона и зона проводимости не перекрываются и отделены друг от друга запрещенной зоной, ширина которой зависит от природы полупроводника и определяет его электронные свойства.
Проводимость полупроводников объясняется либо наличием дефектов в кристаллической решетке, либо переходом электронов в возбужденное состояния в результате какого-либо энергетического воздействия (тепло, свет).
Различают полупроводники i- , n-иp-типа. Полупроводники i-типа имеют узкую запрещенную зону, и электроны с высшего занятого уровня в валентной зоне способны переходить а зону проводимостив результате действия тепловой или световой энергии, в результате чего у материала появляется проводимость. Полупроводники i-типа не играют заметной роли в гетерогенном катализе.

Рис. 5.40. Зонная схема идеального кристалла ZnO.
Гораздо более важны для катализа полупроводники n- и p-типа, проводимость которых вызывается дефектами решетки. Ниже рассмотрена природа возникновения n- и p-проводимости с точки зрения зонной модели.
С химической точки зрения различают два типа дефектных кристаллов:
- Нестехиометрические (с избытком одного из компонентов);
- Примесные (содержащие химическую примесь).
Всякое локальное нарушение периодической структуры решетки приводит к появлению в зонной схеме дискретных (локальных) электронных уровней. Эти локальные уровни располагаются (по энергии) в запрещенной зоне. Положением локальных уровней определяется уровень Ферми и тип проводимости полупроводника.
Если локальные уровни заполнены электронами и находятся близко к зоне проводимости (высокий уровень Ферми, низкая работа выхода), то при повышении температуры электроны с этих уровней могут возбуждаться на уровни зоны проводимости (Рис. 5.41, б). В результате появляется электронная проводимость (n-проводимость), которая растет с ростом концентрации дефектов решетки и температуры. Такие полупроводники относятся к n-типу.
Если, наоборот, локальные уровни не заняты и находятся близко к валентной зоне (низкий уровень Ферми, высокая работа выхода), то возбужденные электроны из валентной зоны могут перемещаться на локальные уровни (Рис. 5.42, б). В результате этого в валентной зоне образуются "дырки" и у материала появляется дырочная проводимость (р-проводимость). Такие полупроводники относятся к р-типу.
Нестехиометрические полупроводники n-типа.
Рассмотрим нестехиометрический полупроводник n-типа на примере Zn(1+х)O. Индекс (1+х) при атоме цинка обозначает избыток атомов цинка по отношению к стехиометрии идеального кристалла.

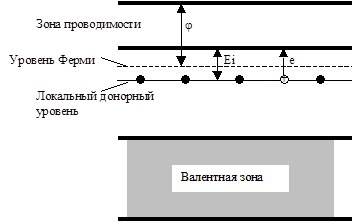
А б
Рис. 5.41. Строение и зонная схема полупроводника n-типа на примере нестехиометрического оксида Zn(1+х)O.
а) Структура Zn(1+х)O с избыточными атомами цинка в междоузлиях.
б) Зонная схема для Zn(1+х)O, объясняющая появление n-проводимости. Еi - энергия возбуждения.
Причина появления избытка атомов цинка заключается в том, что ZnО склонен относительно легко частично терять кислород кристаллической решетки по реакциям:
2Zn2+ + О2- à [2Zn2+ + 0.5O2 + 2e-] à 2[Zn+] + 0.5O2 (5.36)
2Zn2+ + 2О2- à [2Zn2+ + O2 + 4e-] à 2[Zn0] + O2 (5.37)
При этом образуются избыточные центры Zn+ и Zn0, которые занимают места в междоузлиях решетки и являются донорами электронов, т.е. образуют локальные донорные уровни согласно зонной схемы (Рис. 5.41). Соответственно, Zn(1+х)O является полупроводником n-типа. Восстановление Zn2+ по уравнениям (5.36)-(5.37) может происходить либо под действием температуры, либо под действием восстановительной среды (Н2, СО, углеводороды и т.п.)
Очевидно, что при хемосорбции О2 на оксиде цинка проводимость последнего падает, так как кислород - акцептор электронов - образует анион О2-, отнимая электроны у атомов Zn+ и Zn0, т.е. электроны с локальных донорных уровней, обеспечивающих проводимость (фактически, процесс обратный уравнениям (5.36)-(5.37)):
Zn0 + О2 à Zn2+ + О22- (5.38)
При хемосорбции Н2 на оксиде цинка проводимость увеличивается, так как водород - донор электронов. Хемосорбируясь, водород образует поверхностные гидроксильные группы:
Zn2+ + О2- + 0,5Н2 à Zn+ + ОН- (5.39)
либо молекулы воды:
Zn2+ + О2- + Н2 à Zn0 + Н2О (5.40)
При этом образуются Zn+ и Zn0, и число электронов на локальных донорных уровнях возрастает.
Как следует из рассмотреной зонной схемы, полупроводниками n-типа, как правило, являются оксиды металлов в единственной или высшей своей степени окисления (например, ZnO, TiO2, V2O5, MoO3, Fe2O3).
Нестехиометрические полупроводники р-типа.
Рассмотрим нестехиометрический полупроводник р-типа на примере Ni(1-х)O. Индекс (1-х) у никеля обозначает недостаток ионов никеля по отношению к стехиометрии идеального кристалла NiO. Или, иными словами, избыток ионов кислорода.
Избыточный кислород попадает в решетку оксида никеля вследствии способности Ni2+ к окислению до Ni3+:
2Ni2+ + 0,5О2 à 2Ni3+ + О2- (5.41)
Избыточный положительный заряд на Ni3+ приводит к появлению локального акцепторного (не занятого электронами) уровня, и, соответственно, к дырочной проводимости (Рис. 5.42, б).
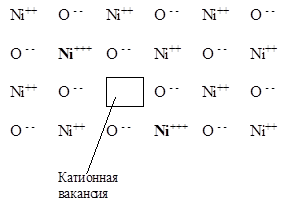

А б
Рис. 5.42. Строение и зонная схема полупроводника р-типа на примере нестехиометрического оксида Ni(1-х)O.
а) Структура Ni(1-х)O с катионными вакансиями.
б) Зонная схема для Ni(1-х)O, объясняющая появление р-проводимости. Еi - энергия возбуждения
Образующиеся по реакции (5.40) катионы Ni3+ остаются в узлах кристаллической решетки, новые катионы О2- встраиваются в решетку, и, таким образом появляется катионная вакансия в кристаллической решетке оксида никеля (Рис. 5.42, а).
Из рассмотренного примера становится очевидным, что полупроводниками р-типа, как правило, являются оксиды металлов в низшей степени окисления, способные окисляться до более высокой степени (например, Ni2+ à Ni3+ ; Co2+ à Co3+ ; Cu+ à Co2+).
Дата добавления: 2020-07-18; просмотров: 408;











