Ферментативный катализ (биокатализ)
Катализ - это возбуждение или изменение скорости химических реакций с помощью внешних добавок - катализаторов. Катализ используется в химической промышленности при получении аммиака, серной и азотной кислот, моторного топлива, разнообразных полимеров. Широко распространен катализ и в живых организмах. С участием катализаторов реализуется генетическая информация и осуществляются все процессы обмена веществ и энергии. Катализ происходит в клетках, в межклеточных жидкостях и полостях, в пищеварительном тракте.
В роли катализаторов биохимических реакций выступают специальные белки, называемые ферментами. При сравнительно низких концентрациях реагирующих веществ и при нормальных температурах (не выше 40 градусов) клеточные реакции ускоряются с помощью ферментов в миллионы и миллиарды раз!
Различают анаболитические, направленные на синтез, и катаболитические, направленные на распад, ферментативные реакции.
Несколько разных ферментов могут образовывать цепочки (метаболические пути), по которым совершаются цепные реакции: вещество (субстрат) передается от фермента к ферменту и подвергается поэтапной перестройке - усложнению или, наоборот, деградации. Чаще всего такие полиферментные комплексы выстраиваются на мембранах клетки или ее органоидов.
Как действуют ферменты? Ферменты очень специфичны по типу катализируемой реакции. Известно несколько тысяч ферментов разного действия, и каждый из них имеет специфическую, отличную от других пространственную структуру. Молекула фермента представляет свернутую полипептидную нить, в определенном месте которой включен небелковый компонент - кофермент (часто это бывают витамины, ионы металлов). Именно этот специфичный участок отвечает за функцию фермента, он называется активным центром. Благодаря молекулярной специфичности своих активных центров ферменты узнают и захватывают нужные вещества-субстраты, сближают их для соединения (синтеза) или, напротив, разделяют в реакциях распада (лизиса). При этом сам фермент не разрушается, а лишь изменяет свою третичную белковую структуру - происходит кратковременная и обратимая денатурация молекулы, ее конформационная перестройка (рисунок).
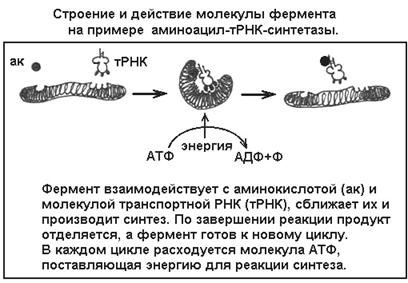
Хотя ферменты и понижают многократно энергию активации соответствующих реакций, для их осуществления все же требуется определенная энергия.
Энергия может генерироваться окислительно-восстановительными кофакторами - такими, как НАД, ФАД или гем. Ферменты класса синтетаз (лигазы) способны расщеплять молекулу АТФ до АДФ и фосфата и используют выделенную энергию на свою конформационную перестройку. После произведенной работы по синтезу сложного вещества большая часть энергии не исчезает и не уходит в виде тепла - она лишь переходит в новые химические связи синтезируемого вещества. Впоследствии - в случае расщепления этого вещества - энергия может быть снова извлечена для производства другой работы.
Даже не вдаваясь в детали ферментативного катализа, видно, что эта важнейшая биологическая функция реализуется как сумма простых физико-химических реакций.
Важнейшие из них - стереохимическое молекулярное узнавание субстрата ферментом и конформационная перестройка молекулы белка-фермента, суть которой, как и в реакциях мышечного сокращения или активного транспорта, состоит в обратимом изменении силы химических связей внутри молекулы. Изучение зависимости скорости ферментативной реакции от концентрации фермента и субстрата показало, что в простейших случаях она описывается уравнением Михаэлиса-Ментен. Из этого следует, что в основе ферментативных реакций лежат те же законы и принципы, на которых основаны обычные химические реакции. Однако единая теория ферментативного катализа до сих пор не разработана, так как механизмы протекания ферментативных реакций очень сложны, многофакторны и разнообразны, зависят от большого числа переменных величин, от взаиморасположения ферментов на мембранах и в ряде случае пока не поддаются математическому описанию. В этом и проявляется эмерджентная специфика биологических реакций как специфика нового уровня сложности.
Дата добавления: 2016-05-30; просмотров: 3126;











