Белки – структурно-функциональная основа жизни
Как уже отмечено, белки представляют полимерные молекулы длиной в 50-100-500 и более мономеров - аминокислот. Имеется 20 разновидностей аминокислот, различных по химическим свойствам их свободных концов - радикалов.
Особо выделим аминокислоты со свободным электрическим зарядом. Так, аспарагиновая и глутаминовая кислоты имеют отрицательный заряд (лишняя –СОО-группа), аргинин, лизин, аспарагин и глутамин - положительный (лишняя –NH+группа). Некоторые аминокислоты имеют свободную гидроксильную группу (–OH) . В совокупности активные группы придают молекуле белка электрический заряд - положительный или отрицательный в зависимости от соотношения аминокислот с разными зарядами. Кроме того, такие аминокислоты как цистеин и метионин имеют на свободном конце серу (группа –SH или –SCH3) и могут формировать между собой -S-S- мостики, стягивая участок полипептидной цепи в петлю.
Эти и другие особенности белковой молекулы, которые целиком зависят от набора и порядка чередования аминокислот (то есть от ее первичной структуры), придают каждой молекуле в водном окружении неповторимую вторичную и третичную (трехмерную) структуру. В каждой белковой молекуле в строго определенных местах есть активные участки, нередко содержащие какой-нибудь металл (железо - Fe, магний - Mg, медь -Cu и др.) или другие специфические соединения. Эти участки обычно и отвечают за особые функции белков.
Важнейшее свойство белковой молекулы, объясняющее механизм ее функционирования, это - способность обратимо изменять свою третичную структуру (трехмерную форму) в ответ на какое-либо раздражение. Раздражителем чаще всего выступает энергетический разряд от расщепления молекулы АТФ. Такая обратимая денатурация, или конформационная перестройка, и есть совершаемая молекулой работа. Конформационная перестройка молекулы подобна циклу сжатия и расслабления пружины: при внешнем давлении пружина сжимается и приобретает внутренний запас энергии, а на обратном ходу совершает работу. В зависимости от структуры белковой молекулы и ее местонахождения совершаемая работа, то есть функция, будет различна. Ниже будет показана роль белков в реализации основных жизненных функции: опорно-двигательной, транспортной, каталитической, защитной, сигнальной.
Обычно называют еще энергетическую функцию белков. Действительно, белки в своей химической структуре несут большой запас энергии. Они могут распадаться на отдельные аминокислоты, которые, в свою очередь, подобно глюкозе окисляются в митохондриях до углекислого газа и воды и отдают энергию на синтез АТФ. Однако этот путь в энергетическом обмене используется как резервный, в тех случаях, когда исчерпаны запасы углеводов и жиров - основных энергоемких субстратов. Использование белков в энергообмене расточительно для клетки, так как аминокислоты представляют дефицитный продукт, многие из них вообще не могут синтезироваться у животных, а получаются от растительных продуктов (незаменимые аминокислоты). Белки имеют уникальную структуру, которой дано более высокое предназначение. В этом смысле расщеплять белки для извлечения энергии – все равно, что топить печь ассигнациями. Кроме того, аминокислоты предварительно необходимо освободить от азота (дезаминировать), чтобы уровнять их с продуктами полураспада глюкозы, а это и дополнительная работа и потеря важнейшего элемента из организма (азот в составе простых соединений выводится с мочой). Таким образом, белки в энергетическом обмене используются в крайних случаях – при голодании, болезни, возрастных метаморфозах. Основные же функции белков, перечисленные выше и рассматриваемые ниже, значительно более важны и изящны, поскольку в их реализации используется уникальность структуры белка, его неповторимые индивидуальные формы и активные центры.
Опора и движение
Опорно-двигательная функция - одна из важных в обеспечении жизнедеятельности клеток и всего организма. Движутся органоиды внутри клетки, сами клетки в воде или по твердой поверхности, организмы в их среде обитания. Движение невозможно без опоры, поэтому и в клетке и в организме формируются комплексные опорно-двигательные структуры. Например, у человека мышцы связаны со скелетом, и только в такой комбинации работа мышц становится эффективной. У позвоночных животных и человека опорные соединительные ткани имеют в межклеточной основе специальный волокнистый белок коллаген (при вываривании костей, сухожилий или связок он набухает и дает клей, отсюда и название белка - клей дающий). В костях межклеточная коллагеновая основа для большей твердости минерализована солями кальция. Имеются опорные белковые микронити и микротрубочки и в самих клетках, они придают клеткам определенную форму, поддерживают отростки (например, в нервных волокнах).
В клетках мышечной ткани имеются специальные сократительные нити -миофибриллы, которые обеспечивают сокращение клеток и всей мышцы. Каждая миофибрилла сложена из молекул белков двух основных видов - актина и миозина (рисунок). Актин образует прочные микронити, по которым буквально шагают ножки миозина. Каждый шаг - это изменение третичной структуры молекулы миозина, его обратимая денатурация под действием энергии АТФ. Когда одна ножка, зацепившись за микронить, изгибается, другая ножка распрямляется и цепляется за новое место на микронити. Потом они меняются ролями - первая ножка отцепляется от микронити и распрямляется, а вторая изгибается и подтягивает нить. Каждый шаг требует энергии АТФ. Таким образом, при наличии АТФ ножки быстро бегут вдоль микронити, а точнее - тянут нить к себе, так как обращенные в разные стороны пучки миозина скреплены хвостиками, и ножки разных пучков тянут свои микронити в противоположных направлениях (см. рисунок).
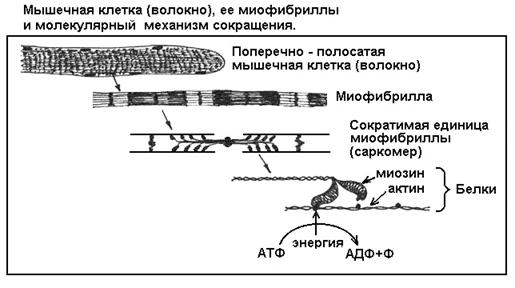
Главное, что следует вынести из описания мышечной функции, это понимание простой физико-химической сущности движения, которая сводится к изменению объемной формы молекулы белка миозина. Эта форма, или третичная структура, в свою очередь зависит от силы химических связей внутри молекулы.
При энергетическом разряде от распада молекулы АТФ сила связей резко, но кратковременно изменяется - молекула «вздрагивает» (сгибается и тут же разгибается), совершая работу. Суть реакции миозина настолько проста, что воспроизводится in vitro («в стекле», в пробирке, то есть в искусственных условиях) на чистых белках, выделенных из клеток, или даже на мертвых клетках при добавлении АТФ. Добавим, что аналогичный механизм движения, но с другими белками, известен для ресничек и жгутиков, которыми снабжены многие одноклеточные организмы (например, инфузория), сперматозоиды, некоторые покровные (эпителиальные) ткани. Итак, движение - важное проявление жизни - имеет вполне материальную сущность.
Транспорт веществ
Перенос веществ между организмом и средой - необходимый этап в процессах обмена веществ. Это - поглощение пищевых материалов и вынос отходов, поглощение кислорода и удаление углекислого газа, перенос неорганических ионов, воды и других веществ. Способы и механизмы поглощения и выделения веществ различаются у организмов разного уровня сложности - у одноклеточных и многоклеточных, животных и растений. На высших уровнях организации – у многоклеточных животных - в эти процессы включаются мышечные и ресничные механизмы: преследование и захват добычи, глотание и перистальтика по кишечнику у позвоночных, нагнетание водных потоков и фильтрация планктона у сидячих беспозвоночных - например, у двустворчатых моллюсков мидии, гребешка. У высших растений для транспорта воды и солей от корней к стеблю и листьям большое значение имеет осмотическая диффузия - движение растворов по градиенту концентрации, то есть из среды с высокой концентрацией вещества в среду с низкой концентрацией. Этот транспорт имеет простую физико-химическую основу и не требует энергетических затрат. Движение синтезированных веществ (сахаров) в обратную сторону, напротив, требует энергии.
Переносу малых молекул часто способствует их связывание с более крупными молекулами-переносчиками. Типичный пример - перенос кислорода из атмосферного воздуха, вдыхаемого через легкие, в кровь и далее во все клетки организма (для окисления пищевых субстратов и извлечения энергии). В этом случае кислород из полости легких под осмотическим давлением поступает в кровеносные капилляры, далее в специальные клетки - эритроциты (красные кровяные тельца), где химически связывается с особым белком гемоглобином. Принцип связывания кислорода с гемоглобином очень прост. В составе этого белка имеются атомы железа, которые и окисляются кислородом - железо временно превращается в окисел (как обычное железо на воздухе превращается в ржавчину). Однако связь железа с кислородом непрочная, так что по мере углубления эритроцитов в ткани организма, где собственная концентрация кислорода ниже, гемоглобин отдает связанный с ним кислород, который теперь диффундирует в клетки, а далее в митохондрии. Решающее значение в транспорте кислорода имеет конфигурация (третичная структура) молекулы гемоглобина, от которой зависит окислительно-восстановительная способность связанного железа. При заболевании, которое называется серповидно-клеточной анемией (эритроциты имеют нетипичную форму серпа), замена всего одной аминокислоты в составе гемоглобина так изменяет его форму, что делает железо не эффективным в отношении кислорода. Дыхание нарушается.
Критическим моментом в транспорте веществ между организмом и средой - будь то одно- или многоклеточный, животный или растительный организм - является преодоление клеточных оболочек. Оболочка клетки включает липидно-белковую мембрану (плазмалемму) и углеводную стенку.
Клеточная стенка, даже очень толстая, как у растительных клеток, не представляет серьезного препятствия для воды и растворенных в ней веществ, но плазмалемм имеет настоящие барьерные свойства, так как ее основу составляют два слоя липидов (жиров), практически не проницаемых для водных растворов. Через билипидный слой легко проникают лишь газы (мелкие электрически нейтральные молекулы) и жирорастворимые вещества (спирты, ацетон и др.). Но клетке нужны прежде всего питательные органические и минеральные вещества. Для переноса заряженных частиц - ионов, а также небольших органических молекул - аминокислот, сахаров и т.п. в липидной мембране вставлены многочисленные белковые поры. Мембрана представляет как бы белковую мозаику по липидному фону. Белки мембранных пор, как и большинство других белков, взаимодействуют с водой, так что пора представляет фактически водный канал. Однако благодаря белковой компоненте каждый такой канал имеет избирательную проницаемость - для ионов K+, Na+, Ca2+, Cl- и др. Вместе с ионами в клетку проникают и связанные с ними органические молекулы - сахара и аминокислоты, так осуществляется питание клеток.
Рассмотренный случай представляет пассивный транспорт веществ, он не требует затрат энергии. Совершенно особый тип каналов представляют ионные насосы, способные перекачивать ионы против градиента их концентрации. Как следует из самого термина, насосы могут работать только с затратой энергии, и такой способ перемещения веществ называют активным транспортом.
Белковая пора насоса способна расщеплять молекулу АТФ и за счет извлеченной энергии проталкивать ионы против их диффузионной силы. Созданный таким образом наружный избыток ионов возвращается обратно пассивным путем, но несет с собой нужные органические вещества. Так сочетание активного и пассивного транспорта обеспечивает питание клеток. Избыток ионов натрия снаружи клетки используется также для возбуждения электрического тока и проведения нервного возбуждения.
Даже поверхностное рассмотрение механизмов мембранного транспорта веществ показывает, что, как и в случае мышечного сокращения, работа по активному транспорту сводится к обратимой конформационной перестройке молекул белковых пор с преобразованием энергии АТФ. Направленный в обратную сторону пассивный транспорт ионов и питательных веществ представляет простую диффузию, но является следствием предшествующего активного транспорта. Все эти процессы подчиняются в основе известным физико-химическим закономерностям.
Дата добавления: 2016-05-30; просмотров: 3166;











