Точкові дефекти в нестехіометричних кристалах
Важливу групу реальних кристалів складають нестехіометричні кристали, які характеризуються надлишком або нестачею однієї із компоненти по відношенню до стехіометричної формули речовини. Валентність катіона у випадку надлишку металу - зменшується, а у випадку не металу - зростає.
Точкові дефекти в кристалах нестехіометричного складу зручно розглянути на прикладі NaCl. При нагріванні його в порах Na стехіометричне співвідношення порушується із-за збільшення катіонної компоненти. Na втілюється в гратку на звичайні катіонні місця у вигляді іонів Na+ (іон Na+ викликає менші спотворення гратки) при цьому утворюється деякий надлишок електронів і вакансійних вузлів ƒ  в аніонній підгратці. Ці вакансії представляють собою центри з додатнім ефективним зарядом. Тому між надлишковими електронами і аніонними вакансіями виникає кулонівська взаємодія: вакансія ƒ
в аніонній підгратці. Ці вакансії представляють собою центри з додатнім ефективним зарядом. Тому між надлишковими електронами і аніонними вакансіями виникає кулонівська взаємодія: вакансія ƒ  є потенціальною ямою для електрона. Подібні утворення представляють собою квантомеханічну систему з певним набором дозволених електронних енергетичних рівнів. У першому наближенні така квантомеханічна система подібна до атому водню.
є потенціальною ямою для електрона. Подібні утворення представляють собою квантомеханічну систему з певним набором дозволених електронних енергетичних рівнів. У першому наближенні така квантомеханічна система подібна до атому водню.
Електрон разом з аніонною вакансією ƒ  , утворюють F- центр, його утворення можна записати у вигляді
, утворюють F- центр, його утворення можна записати у вигляді
ƒ  +е
+е 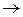 (е
(е 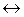 ƒ
ƒ 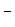 ) = Fц .
) = Fц .
Тут знак 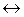 означає наявність деякого зв’язку між складовими центру.
означає наявність деякого зв’язку між складовими центру.
F- центр відповідає електрону, який знаходиться в потенціальній ямі і визначається локальним надлишковим електричним зарядом іонів, які оточують аніонну вакансію (рис.1.6). F - центри надають кристалам, наприклад, NaCl нові оптичні і електричні властивості.
Можливі і більш складні утворення, коли з аніонною вакансією зв’язуються два електрони, так звані 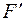 - центри, або різні комбінації F-центрів:
- центри, або різні комбінації F-центрів:
2Fц = Fц 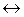 Fц = Мц
Fц = Мц
ƒ 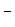 +
+ 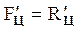 .
.
Всі ці дефекти відповідають за забарвлення кристалу, а тому носять назву центрів забарвлення. Їх наявність приводить до появи нових додаткових смуг поглинання у видимій частині спектру. Електронні центри, при певних умовах, можуть віддати надлишковий електрон, тобто вони є донорами електронів. За рахунок цих електронів у кристалах при накладанні потенціалу може виникнути провідність, яку прийнято називати провідністю n-типу.
 Na
Na  Cl
Cl  Na
Na  Cl
Cl 
Cl 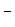 Na
Na 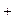 е- Na
е- Na 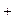
Na 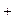 Cl
Cl 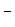 Na
Na 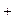 Cl
Cl 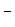
Рис.1.6. Схема утворення F-центра в кристалі NaCl при порушенні його стехіометрії в сторону збільшення катіонної складової.
Порушення стехіометричної рівноваги, із-за збільшення аніонного компоненту, супроводжується утворенням вакансійних вузлів ƒ 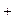 у катіонній підгратці. Ці вакансійні вузли в кристалі грають роль центрів із ефективним негативним зарядом, кулонівське поле яких може зв’язувати позитивний заряд. Прикладом цього типу речовин є окис заліза FeO. При введенні у FeO надлишку атомів О, кисень відбирає у катіона додатковий електрон. В результаті у подібного іона утворюється вакантний електронний енергетичний стан. Якщо електрон у сусіднього іона переходить на перший іон, вакантний електронний енергетичний рівень переходить до другого іона. Цей процес може продовжуватися далі, тобто електронний енергетичний рівень переміщується через кристал.
у катіонній підгратці. Ці вакансійні вузли в кристалі грають роль центрів із ефективним негативним зарядом, кулонівське поле яких може зв’язувати позитивний заряд. Прикладом цього типу речовин є окис заліза FeO. При введенні у FeO надлишку атомів О, кисень відбирає у катіона додатковий електрон. В результаті у подібного іона утворюється вакантний електронний енергетичний стан. Якщо електрон у сусіднього іона переходить на перший іон, вакантний електронний енергетичний рівень переходить до другого іона. Цей процес може продовжуватися далі, тобто електронний енергетичний рівень переміщується через кристал.
Вакантний електронний рівень, який рухається через кристал, називається позитивною діркою, оскільки його рух еквівалентний руху позитивного електричного заряду.
Диркові центри можуть прийняти надлишковий електрон. Тому вони називаються акцепторами. При накладанні електричного поля в таких кристалах появляється провідність, яка зумовлена рухом позитивних дирок, називається р-провідністю. Позитивні дирки можуть бути зв’язані з центрами, які мають у кристалах ефективний негативний заряд, наприклад, з вакантними катіонними вузлами ƒ 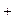 .
.
Позитивна дирка, яка зображена катіонною вакансією називається V1 - центром. Можливі і більш складні утворення:
2×V1ц = V2ц
ƒ 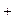 +V1ц = V3ц
+V1ц = V3ц
Диркові центри також відповідальні за смуги поглинання, але, як правило, в ультрафіолетовій області спектру.
Зауважимо, що в деяких речовинах одночасно можуть співіснувати без зміни фази, як надлишковий метал, так і металоїд.
Контрольні питання
1. Які кристали вважаються не стехіометричними? Приведіть приклади.
2. Пояснити фізичний зміст утворення центрів забарвлення в кристалах.
3. Дати пояснення творення F-центру в NaCl та Vц центра в FeO.
Дата добавления: 2020-07-18; просмотров: 742;











