Ідеальні та реальні кристали.
Реальний кристал відрізняється від ідеального наявністю різного роду дефектів, які обумовлюють виникнення порушень періодичності структури кристалу, і більш тонких дефектів, які пов’язані із змінами в структурі, або станів атомів чи іонів в кристалічній гратці. Особливу важливу роль відіграють ті дефекти, які визначають так звані структурно-чутливі властивості твердих тіл. Без врахування дефектів не можливо зрозуміти механізми переносу речовини в кристалах, процеси взаємної дифузії двох твердих фаз. Всі хімічні реакції в твердому стані також не можливо уявити, не взявши до уваги наявність чи можливість утворення дефектів. Знання властивостей дефектів необхідне для опису електричних чи оптичних властивостей існуючих в природі, чи штучно вирощених кристалів. Особливого роду лінійні дефекти - дислокації - визначають пластичні властивості металів. Властивість кристалічних тіл міняти свою форму при дії зовнішніх сил визначається також головним чином дефектами. Слід також зауважити, що властивості кристала залежать не тільки від того, як розміщені структурні елементи в просторі, але і від того, які властивості цих саме елементів. Крім того, для характеристики кристалу, необхідно знати і характер теплового руху його структурних одиниць.
У загальному випадку модель ідеального кристалу можна охарактеризувати за наступними ознаками:
1) при температурі абсолютного нуля (Т=0 0К) атоми (іони, молекули) повинні розміщуватися в вузлах кристалічної гратки, розміщення яких в просторі визначається співвідношенням
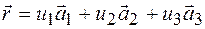 ,
,
2) допускається, що при Т 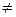 0 0К атоми здійснюють гармонічні коливання навколо положень рівноваги, які співпадають з вузлами гратки;
0 0К атоми здійснюють гармонічні коливання навколо положень рівноваги, які співпадають з вузлами гратки;
3)система гармонічних осциляторів повинна знаходитися в термодинамічній рівновазі при заданих зовнішніх умовах.
Структура ідеального кристалу володіє так званим дальнім порядком. Альтернативою дальному порядку є ближній порядок - правильне розміщення атомів у малих об’ємах. Сюди належать неупорядковані сплави, рідини, аморфні тіла. Модель ідеального кристалу дозволяє описати такі властивості кристалів, для яких основним являється збереження дальнього порядку (електричні властивості, теплопровідність і т.д.).
Кристал називається реальним, якщо не виконана хоча б одна із вище наведених ознак.
Якщо деякіатоми, при певних умовах, покидають вузли кристалічної гратки, то при цьому відбувається порушення ближнього порядку кристалу із збереженням дальнього. Поява таких областей локального розупорядкування обов’язково пов’язана із зовнішніми умовами (діями), до числа яких відноситься і нагрівання і опромінення (іонами, електронами, гамма-квантами, лазерним промінням і т.д.). Утворення дефектів підвищує внутрішню енергію кристалу, але водночас зростає його конфігураційна ентропія. Тому при Т  0 0К правильне розміщення атомів не завжди відповідає умові термодинамічної рівноваги. Із цього слідує, що 1) та 2) умови можуть виконуватися одночасно тільки при Т=0 0К.
0 0К правильне розміщення атомів не завжди відповідає умові термодинамічної рівноваги. Із цього слідує, що 1) та 2) умови можуть виконуватися одночасно тільки при Т=0 0К.
Встановлення термодинамічної рівноваги в кристалі контролюється процесами переносу, в тому числі і дифузією, швидкість якої в твердих тілах мала. При цьому слідує мати на увазі, що не досконалість кристалу не обов’язково пов’язана тільки з порушенням ближнього порядку. Можуть бути «дефекти» в структурі атома чи іона, також відхилення від рівноважного розподілу електронів по енергетичним рівням.
Нагадаємо, що згідно III-ну закону термодинаміки ентропія ідеального кристалу чистої речовини при абсолютному нулі рівна нулю. Абсолютне значення ентропії, як параметра системи, на відміну від внутрішньої енергії, може бути визначене. (Постулат М. Планка, 1911р.)
Ентропія - міра статистичного безладдяв замкнутій термодинамічній системі. Всі процеси, що самодовільно протікають у замкнутій системі наближають систему до стану рівноваги й супроводжуються ростом ентропії, спрямовані убік збільшення ймовірності стану W (Больцман).
Термодинамічна ймовірність Wстану системи - це число способів, якими може бути реалізований даний стан макроскопічної системи, або число мікростанів, що здійснюють даний макростан (W>> 1).
Наслідки із II закону термодинаміки(закони Мерфі):
1. Чудес не буває.
2. Якщо яка-небудь неприємність може відбутися, то вона таки буде.
3. Із всіх неприємностей відбудеться саме та, збиток від якої найбільше.
4. Самі собі події мають тенденцію розвиватися від поганого до гіршого.
5. Якщо експеримент зразу удався, то тут щось не так (перший закон Фінейгла)
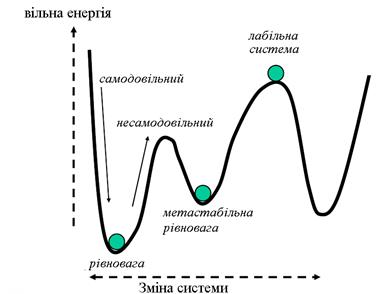
Рис.1.1. Хід рівноважних і квазірівноважних процесів у кристалах
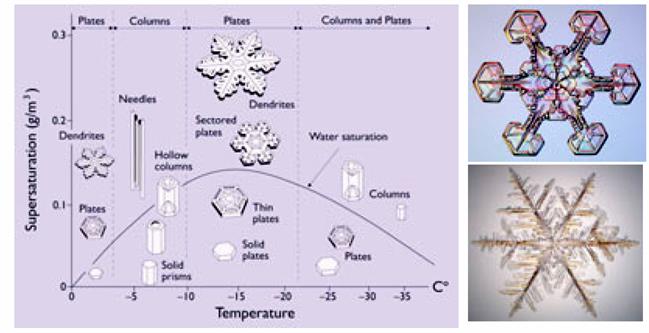
Рис. 1.2. Вплив температури на зміну агрегатного стану води. Приклад
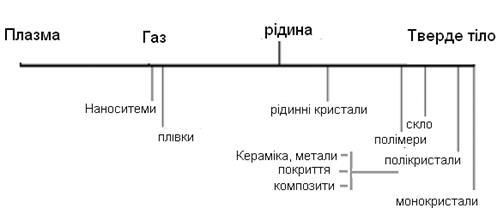
Рис. 1.В. Форми матеріалів
|
|
|
|
|
|
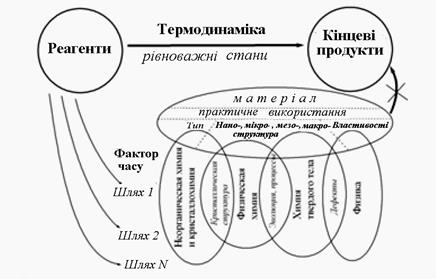
Рис.1. 3. Приклади зміни термодинамічних рівноважних станів у твердих тілах і розділи науки, які їх вивчають
Контрольні питання
1. Пояснити означення – «ідеальний кристал».
2. Якими критеріями визначається поняття – «реальний кристал»?
3. Пояснити різницю між «ідеальним» та «реальним» кристалами.
4. Пояснити фізичний зміст визначення «термодинамічна рівновага».
5. Що таке «ентропія»? Дати фізичне пояснення.
6. Пояснити, що таке термодинамічна ймовірність станів?
7. Привести приклади зміни термодинамічних рівноважних станів у твердих тілах.
Дата добавления: 2020-07-18; просмотров: 1281;











