Межмолекулярные силы Ван-дер-Ваальса
Так как вещества, состоящие из полностью насыщенных электронами молекул (с замкнутыми 8- и 18-электронными оболочками всех атомов, например CH4, N2O5) и не содержащие ионов (H2, Ar, N2), при понижении температуры сжижаются и кристаллизуются, то очевидно, что между молекулами существуют какие-то нерассмотренные выше межмолекулярные взаимодействия. Эти силы были названы именем голландского физика Ван-дер-Ваальса, который внес большой вклад в изучение процессов конденсации газов. Было установлено, что эти силы имеют 3 составляющие.
Ориентационное взаимодействие.Оно проявляется, если вещество состоит из полярных молекул - диполей (диполь-дипольное взаимодействие). В результате беспорядочного теплового движения молекул при их сближении друг с другом диполи в веществе ориентируются с выигрышем энергии (рис. 3.29). Чем более полярны молекулы, тем сильнее они притягиваются и тем сильнее ориентационное взаимодействие. Такое взаимодействие характерно для полярных молекул (NH3, H2O и др.).
Повышение температуры ослабляет это взаимодействие, так как тепловое движение нарушает взаимную ориентацию молекул. Притяжение полярных молекул быстро уменьшается с расстоянием между ними.
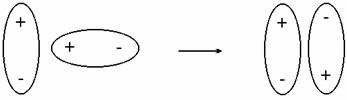
Рис. 4.29. Ориентация диполей
Индукционное взаимодействие.Оно осуществляется, в частности, между полярной и неполярной молекулой и обусловлено тем, что дипольные молекулы индуцируют в соседних молекулах диполи. Индуцированные диполи взаимодействуют между собой и другими диполями, что дает выигрыш в энергии. Энергия этого взаимодействия тем больше, чем больше поляризуемость молекул. Например, в H2S это взаимодействие больше чем в Н2О, так как поляризуемость S2- больше чем O2-.
Дисперсионное взаимодействие.Это взаимодействие обусловлено тем, что каждый атом является диполем в любой момент времени, т.к. электрон и ядро являются противоположно заряженными частицами (мгновенный диполь). Если имеется несколько атомов поблизости, то их диполи ориентируются в пространстве ("+" к "-") с выигрышем энергии. Такое взаимодействие характерно для любых атомов и молекул. Оно тем больше, чем более тяжелыми являются частицы (больше зарядов - больше взаимодействий). Дисперсионное взаимодействие наиболее универсальное, то есть проявляется в любых случаях.
Суммарная энергия межмолекулярного взаимодействия обычно около 10 кДж/моль. Наименьший вклад обычно вносит индукционное взаимодействие. В случае атомов (He, Ar и др.) и неполярных молекул (H2, N2 и др.) наибольший вклад дает дисперсионное взаимодействие.
Все три вида взаимодействия возрастают с ростом молекулярной массы.
По сравнению с ковалентной связью ван-дер-ваальсово взаимодействие очень слабое. Так, если энергия, необходимая для диссоциации молекулы Cl2 на атомы составляет 243 кДж/моль, то энергия сублимации (возгонки) кристаллов Cl2 составляет всего 25 кДж/моль.
Дата добавления: 2016-07-05; просмотров: 4684;











