Ионообменные реакции
Для растворов электролитов характерно протекание реакций без изменения степени окисления, в ходе которых происходит простой обмен ионами. Прежде всего это реакции взаимодействия сильных кислот с сильными основаниями:
1) HCl + NaOH = NaCl + H2O ,
2) HNO3 + Ba(OH)2 = Ba(NO3)2 + 2H2O.
В этих реакциях некоторые ионы совершенно не изменяются. Например, в первой реакции это ионы Cl- и Na+ . Действительно, в растворе HCl, NaOH и NaCl - сильные электролиты, то есть существуют в виде ионов:
Н+ + Cl- + Na+ +ОН- = Cl- + Na+ + H2O.
Сокращая одинаковые ионы слева и справа, получаем ионную реакцию нейтрализации сильной кислоты сильным основанием:
Н+ + ОН- = H2O ,
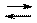
которая имеет место в приведённых выше реакциях нейтрализации сильных кислот сильными основаниями. Движущей силой этой реакции является образование слабодиссоциирующей молекулы H2O. Она характеризуется константой равновесия: 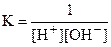 .
.
Если хотя бы один из реагентов - слабая кислота или слабое основание, то сущность реакции выражается другими ионными уравнениями:
HNO2 + Ba(OH)2 = Ba(NO2)2 + H2O,
HNO2 + OH- = NO2- + H2O,
HNO3 + NH4OH = NH4+ + NO3- + H2O,
Н+ + NH4OH = NH4+ + H2O,
и характеризуются константами равновесия:
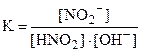 и
и 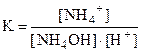 ,
,
в которых, кроме образования воды, играет роль диссоциация слабо- диссоциирующего соединения (HNO2 и NH4OH - в приведенных примерах).
Другие обменные реакции также сопровождаются образованием слабых электролитов – слабодиссоциирующих осадков и молекул (что и является движущей силой этих реакций):
Na2SO4 + Ba(NO3)2 = 2NaNO3 + BaSO4¯ ,
Ba2+ + SO42- = BaSO4¯ .
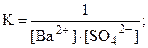
 Na2CO3 + 2HCl = 2NaCl + H2CO3 ( Н2О + СО2),
Na2CO3 + 2HCl = 2NaCl + H2CO3 ( Н2О + СО2),
 СО32- + 2Н+ = H2CO3 ( Н2О + СО2).
СО32- + 2Н+ = H2CO3 ( Н2О + СО2).
Пример 16. Записать в ионно-молекулярной форме уравнение реакций между следующими веществами:
а) Н2SO4 и Fe(OH)3; б) Na2CO3 и HCl.
;
Решение. Обменные реакции в растворах электролитов протекают в направлении образования малорастворимых веществ, осадков (см. табл. 6.2), газов или молекул слабых электролитов (см. табл. 6.3). Запишем уравнение реакции:
а) 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3+ 6H2O.
Так как Fe(OH)3 - малорастворимое вещество, а Н2О - слабый электролит, их записываем в молекулярной форме:
2Fe(OH)3 + 6H+ + 3SO42- = 2Fe3+ + 3SO42- + 6H2O.
Ионы, не участвующие в реакции, сокращаются. Конечное уравнение имеет вид
Fe( OH)3 + 6H+ = 2Fe3+ + 6H2O.
б) В результате реакции Na2CO3 + 2HCl = 2NaCl + H2CO3
получается кислота, которая в момент образования распадается на СО2 и Н2О.
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + CO2 + H2O.
Конечное уравнение имеет вид CO32- + 2H+ = CO2 +H2O.
Пример 17. По ионно-молекулярной реакции Pb2+ + S2- = PbS ¯ составьте два молекулярных уравнения.
Решение. В левой части указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, из табл. 6.2 выбираем электролиты, содержащие эти ионы:
Pb(NO3)2 + Na2S = ¯PbS + 2NaNO3 или
Pb(CH3COO)2 + (NH4)2S = ¯PbS + 2CH3COONH4 .
Часто возникает необходимость быстрой качественной оценки силы оснований и кислот без использования соответствующих табличных данных. Поэтому полезно сформулировать несколько простейших правил, пригодных для растворов обычных (~ 0,1М) концентраций.
1.Сильными являются основания, образованные щелочными, щелочно-земельными металлами и Tl+, причем их сила возрастает с ростом атомной массы и радиуса катиона. Остальные основания – слабые.
2.Сила оснований уменьшается с увеличением заряда катиона. Таким образом, с учетом правил 1 и 2 основания Ba2+, Sr2+, Ca2+ - довольно сильные, их сила уменьшается в этом ряду; основание Mg(OH)2 - средней силы, а Be(OH)2 - слабое.
3.Сила бескислородных кислот возрастает с уменьшением энергии связи Н-Э и уменьшением отрицательного заряда Эn-.
Таким образом, в ряду HF, HCl, HBr, HI сила кислоты возрастает (HF - слабая кислота, хотя она и весьма активна во многих реакциях, например, растворяет стекло, кварц!); однако, HF все же сильнее, чем H2O, и тем более чем H3N.
4.В случае кислородных кислот общей формулы 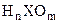 можно сформулировать несколько правил:
можно сформулировать несколько правил:
Таблица 6.2.
Дата добавления: 2016-07-05; просмотров: 3776;










