Физические свойства
СПИРТЫ И ФЕНОЛЫ
Спирты– это производные углеводородов, содержащие гидроксильную группу –ОН.
Классификация спиртов
1. По типу углеводородного радикала R, связанного с гидроксильной группой, различают: предельные, непредельные и ароматические спирты.
2. По атомности, т.е. по числу гидроксильных групп, спирты делятся на одноатомные, двухатомные (гликоли), трехатомные (глицерины) и многоатомные.
3. 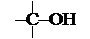 По расположению гидроксильной группы в углеродной цепи спирты принято делить на первичные (–СН2–ОН), вторичные (>СН–ОН) и третичные ( ).
По расположению гидроксильной группы в углеродной цепи спирты принято делить на первичные (–СН2–ОН), вторичные (>СН–ОН) и третичные ( ).
Одноатомные спирты
Одноатомные спирты содержат одну гидроксильную (или окси-) группу и могут быть предельными, непредельными и ароматическими.
Строение, изомерия, номенклатура
Предельные спирты. Общая формула CnH2n+1OH.
Важнейшие представители одноатомных спиртов:
СН3ОН – метиловый спирт (метанол)
СН3–СН2ОН – этиловый спирт (этанол)
СН3–СН2–СН2ОН – н-пропиловый спирт (пропанол-1) (первичный)
СН3–СН(ОН)–СН3 – изопропиловый спирт (пропанол-2) (вторичный)
Непредельные спирты:
СН2=СНОН – виниловый спирт (этенол)
СН2=СН–СН2ОН – аллиловый спирт (пропенол)
Ароматические спирты:
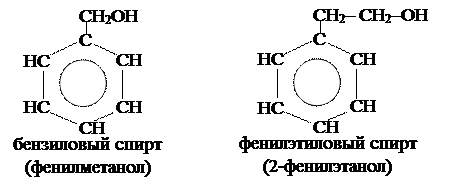 |
В соответствии с правилами номенклатуры ИЮПАК названия спиртов складываются из названия соответствующего углеводорода, к которому прибавляется окончание «-ол».
Предельные спирты
Нахождение в природе. Одноатомные спирты в природе в свободном состоянии встречаются в небольших количествах. Они входят в состав душистых веществ, эфирных масел. Широко распространены производные спиртов в виде простых и сложных эфиров.
Способы получения
1. Брожение сахаристых веществ растительного сырья (картофель, рис, хлебные злаки) используется для получения этилового спирта.
Брожение - бескислородный распад органических веществ, происходящий под действием биологических катализаторов (ферментов), вырабатываемых микроорганизмами:
С6Н12О6 → 2С2Н5ОН + 2СО2 + 105 кДж.
глюкоза этиловый
спирт
2. Присоединение воды к алкенам (реакция гидратации) происходит при температуре 300оС:
Н2С=СН2 + Н2О ® СН3–СН2ОН
этилен этиловый спирт
1. Щелочной гидролиз галогенопроизводных алканов – общий способ введения гидроксильной группы в органическую молекулу:
СН3–СН2CI + NаОН ® СН3–СН2ОН + NaCI
хлористый (вод. р-р) этанол
этил
4. Восстановление альдегидов и кетонов. При этом из альдегидов образуются первичные спирты, из кетонов – вторичные:
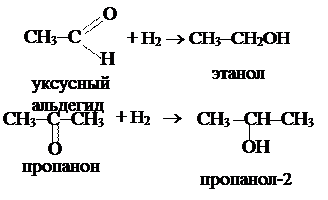 |
Физические свойства
Низшие гомологи спиртов - бесцветные жидкости с характерным запахом, растворимые в воде, средние (до С11) – жидкости, высшие спирты – твердые вещества, не растворимые в воде.
Температура кипения спиртов выше, чем у соответствующих углеводородов. Так, метан – газ, кипит при Ткип=162оС, метиловый спирт – жидкость, Ткип=64,7оС. Это объясняется тем, что молекулы спиртов, так же как молекулы воды, ассоциированы между собой за счет водородных связей.

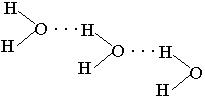
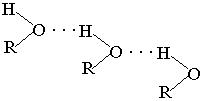
Водородная связь – это вид связи, которая образуется в результате донорно-акцепторного взаимодействия подвижного атома водорода (акцептора) с неподеленной парой электронов атома кислорода (донора).
Дата добавления: 2020-06-09; просмотров: 566;











