Исследование минерализатов на наличие хрома
После разрушения биологического материала серной и азотной кислотами в полученном минерализате хром в основном находится в трехвалентном состоянии. Для обнаружения хрома в минерализатах применяют реакцию образования надхромовой кислоты и реакцию с дифенилкарбазидом.
Реакция образования надхромовой кислоты. Ионы хрома Cr 3+ окисляют при помощи персульфата аммония в присутствии катализатора (соли серебра) до дихромат-ионов. После прибавления пероксида водорода к дихромату образуется надхромовая кислота, имеющая голубую или сине-голубую окраску. Этой кислоте приписывают несколько формул: Н 2 CrO 6, Н 3 CrO 8, Н 7 CrO 10 и др.
Образование надхромовой кислоты можно представить следующими уравнениями:
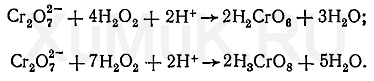
Чувствительность реакции образования надхромовой кислоты понижается в присутствии солей железа (III) и сурьмы (III), для маскировки которых прибавляют фосфаты. Надхромовая кислота быстро разлагается в водных растворах. Поэтому из водных растворов ее экстрагируют органическими растворителями (этиловый эфир, этилацетат, амиловый спирт и др.), в которых надхромовая кислота более устойчива, чем в воде.
Выполнение реакции. В пробирку вносят 5 мл минерализата, по каплям прибавляют 30%-й раствор гидроксида натрия до рН = 7. Затем в пробирку вносят еще 1 мл минерализата и содержимое пробирки взбалтывают. После этого в пробирку вносят 1—2 капли 10 %-го раствора нитрата серебра, 0,5 г персульфата аммония и нагревают на кипящей водяной бане в течение 20 мин. Затем пробирку с содержимым охлаждают в ледяной воде в течение 10—15 мин. К охлажденной жидкости добавляют 1 мл насыщенного раствора дигидрофосфата натрия и проверяют рН среды. При необходимости жидкость доводят до рН=1,5—1,7. После этого в пробирку вносят уксусно-этиловый эфир, толщина слоя которого должна быть около 0,5—0,6 см, и 2—3 капли 25 %-го раствора пероксида водорода. Содержимое пробирки энергично взбалтывают. При наличии ионов хрома Cr 3+ в мине-рализате слой органического растворителя приобретает окраску (от голубой до синей). Предел обнаружения: 2 мкг хрома в 1 мл. Граница обнаружения: 0,2 мг хрома в 100 г биологического материала.
Реакция с дифенилкарбазидом. При выполнении этой реакции ионы хрома, находящиеся в минерализате, окисляют персульфатом аммония в присутствии катализатора (ионы серебра) до дихромат-ионов. Чувствительность этой реакции понижают ионы железа (III), сурьмы (III) и др. Для маскировки мешающих ионов прибавляют фосфаты.
Образовавшиеся дихромат-ионы реагируют с дифенилкарбазидом. Вначале дихромат-ионы окисляют дифенилкарбазид (I) до дифенилкарбазона (II), который не имеет окраски. При дальнейшем окислении образуется дифенилкарбадиазон (III), имеющий светло-желтую окраску:
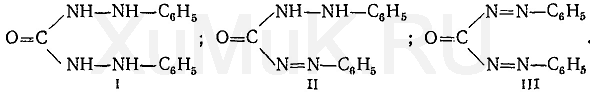
При этой реакции дихромат-ионы восстанавливаются до двухвалентного хрома Cr 2+, но не до Cr 3+. Ионы Cr 2+ с енольной формой дифенилкарбазона (IV) дают внутрикомплексную соль (V), имеющую красно-фиолетовую окраску:
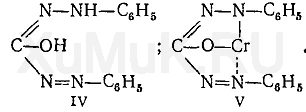
Выполнение реакции. В пробирку вносят 1 мл минерализата, к которому прибавляют 4 мл воды, 1 каплю 10 %-го раствора нитрата серебра и 0,5 г персульфата аммония. Пробирку со смесью нагревают на кипящей водяной бане в течение 20 мин, а затем в нее вносят 1 мл насыщенного раствора дигидрофосфата натрия и по каплям добавляют 5 %-й раствор гидроксида натрия до рН=1,5—1,7. После доведения жидкости до указанного рН к ней добавляют 1 мл 0,25 %-го раствора дифенилкарбазида в смеси этилового спирта и ацетона (1:1) и взбалтывают содержимое пробирки. При наличии ионов хрома в минерализате раствор приобретает розовую или красно-фиолетовую окраску. Предел обнаружения: 0,002 мкг хрома в 1 мл. Граница обнаружения: 0,1 мг хрома в 100 г биологического материала.
Обнаружение хромат-ионов в присутствии перманганат-ионов. Обнаружению хромат-ионов при помощи реакции с дифенилкарбазидом мешают перманганат-ионы, имеющие собственную окраску. Поэтому перед выполнением реакции на хромат-ионы с дифенилкарбазидом восстанавливают перманганат-ионы при помощи азида натрия NaN 3, который представляет собой соль азотистоводородной кислоты Η—Ν=Ν≡Ν. Хромат-ионы с азидом натрия практически не реагируют. Несколько кристалликов азида натрия достаточно для быстрого восстановления перманганат-ионов.
Выполнение реакции. В углубление на капельной пластинке вносят каплю исследуемого раствора, прибавляют каплю концентрированной серной кислоты и несколько кристалликов азида натрия. Смесь перемешивают стеклянной палочкой до исчезновения окраски перманганат-ионов. Затем прибавляют каплю 1 %-го спиртового раствора дифенилкарбазида. В присутствии хроматов появляется сине-фиолетовая или красная окраска. Предел обнаружения: 0,5 мкг хромат-ионов в пробе.
СОЕДИНЕНИЯ ЦИНКА
Все объявления
ЯндексДирект
Дать объявление
- Низкотемпературные камеры
низкотемпературные морозильники с температурным режимом -24С, -55С, -85С
Адрес и телефон · www.winecoolers.ru
Применение и токсичность соединений цинка. Цинк и его соединения широко используются в народном хозяйстве, а некоторые из них применяются и в медицине. Металлический цинк входит в состав ряда сплавов, имеющих значение в технике (бронза, латунь и др.). Цинк применяется для покрытия железа с целью защиты его от коррозии, а также для изготовления цинковой посуды. Оксид цинка применяется в медицине как вяжущее средство в виде мазей и паст. В промышленности он применяется для приготовления красок (цинковых белил). Хлорид цинка употребляется для изготовления пергаментной бумаги, входит в состав жидкости для пайки. Сульфат цинка используется в офтальмологии. Он применяется в качестве протравы при крашении тканей. Сульфид цинка применяется для изготовления светящихся красок. Фосфид цинка — очень токсичный. Его применяют для борьбы с грызунами. Стеарат цинка входит в состав пудры и некоторых мазей. Ундецилат цинка является противомикозным средством. Соединения цинка применяются в химических лабораториях в качестве реактивов. Незначительные количества цинка содержатся в тканях организма (см. табл. 7).
Цинк и его соединения могут поступать в организм через пищевой канал, а также через органы дыхания в виде пыли, образующейся при добыче и переработке цинковых руд. Цинк может поступать в организм с вдыхаемым воздухом в виде паров, выделяющихся при выплавке цинка и получении сплавов. После поступления цинка в организм в виде пыли и паров образуются его соединения с белками, вызывающие приступы лихорадки, начинающейся с озноба (так называемая лихорадка литейщиков, или латунная лихорадка). При вдыхании пыли и паров цинка может появиться тошнота, рвота и мышечные боли. Описаны случаи отравлений пищей, приготовленной и сохраняемой в оцинкованной посуде, из продуктов, содержащих кислоты (богатые кислотами фрукты, томат и др.). Соединения цинка, поступившие в желудок, могут вызывать острое отравление, при котором наступает рвота, понос, судороги и т. д.
При отравлениях соединениями цинка они накапливаются в печени и поджелудочной железе.
Дата добавления: 2016-06-29; просмотров: 2442;











