Обнаружение синильной кислоты и цианидов
Изолирование синильной кислоты и цианидов из биологического материала производят перегонкой с водяным паром. Для этой цели собирают 3—5 мл первого дистиллята в пробирку,
содержащую 2 мл 2 %-го раствора гидроксида натрия. Поскольку синильная кислота быстро разлагается в организме, исследование биологического материала на наличие этой кислоты и ее солей желательно проводить сразу же после вскрытия трупов.
При отравлении синильной кислотой и цианидами на химико-токсикологическое исследование берут желудок с содержимым, печень и почки. Ввиду быстрого разложения синильной кислоты и цианидов в тканях организма эти яды можно обнаружить в содержимом желудка и не обнаружить в паренхиматозных органах.
При заключении об отравлении синильной кислотой и цианидами (на основании результатов химико-токсикологического анализа биологического материала) следует учитывать то, что цианиды в небольших количествах (около 6 мкг %) могут быть в моче лиц, неподвергавшихся воздействию этих соединений. В моче курящих количество цианидов может быть почти в 3 раза больше, чем в крови некурящих. В крови цианиды могут образовываться и посмертно.
Для обнаружения синильной кислоты в дистиллятах применяют несколько реакций, из которых наиболее доказательной является реакция образования берлинской лазури. Другие описанные ниже реакции используют как вспомогательные, а также для обнаружения цианидов в порошках, жидкостях и в других объектах.
Реакции на синильную кислоту и ее соли выполняют под тягой.
Реакция образования берлинской лазури.От прибавления сульфата железа (II) к щелочному раствору цианидов, образуется цианид железа (II), который при взаимодействии с избытком цианидов, а затем с сульфатом или хлоридом железа (III) образует берлинскую лазурь:
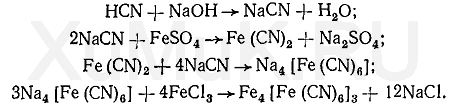
При образовании берлинской лазури происходят и побочные реакции между солями железа и щелочью (образуются гидро-ксиды железа).
Для растворения гидроксидов железа и нейтрализации избытка щелочи прибавляют кислоту до кислой реакции. Большой избыток прибавленной кислоты может замедлить процесс образования берлинской лазури.
Выполнение реакции.К нескольким миллилитрам дистиллята, собранного в раствор щелочи, прибавляют 1—4 капли разбавленного раствора сульфата железа (II) и такой же объем разбавленного раствора хлорида железа (III). Смесь хорошо взбалтывают и нагревают на пламени газовой горелки почти до кипе-
ния, а затем охлаждают до комнатной температуры и прибавляют 10 %-й раствор соляной кислоты до слабокислой реакции на лакмус. Появление синего осадка или синей окраски указывает на наличие синильной кислоты (цианидов) в дистилляте.
Предел обнаружения: 20 мкг синильной кислоты в 1 мл раствора. Предельная концентрация 1 : 100000. При количествах синильной кислоты, превышающих 30 мкг в 1 мл, образуется синий осадок. При наличии 20—30 мкг синильной кислоты в 1 мл появляется зеленая или голубоватая окраска. При малых количествах синильной кислоты в растворах синяя окраска появляется только через 24—48 ч. При длительном отсутствии синего осадка или синей окраски к смеси прибавляют 5 %-ый раствор хлорида бария. При этом выпадает осадок сульфата бария и происходит соосаждение берлинской лазури.
Осадок берлинской лазури может быть представлен судебно-следственным органам как доказательство наличия синильной кислоты или цианидов в исследуемых объектах.
Реакция образования роданида железа.Эта реакция основана на том, что при нагревании цианидов с раствором полисульфида аммония образуется роданид, от прибавления к которому раствора хлорида железа (Ш) появляется кроваво-красная окраска:
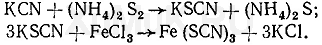
Выполнение реакции.К 2—3 мл исследуемого раствора прибавляют 3—5 капель 10—20 %-го раствора полисульфида аммония и смесь упаривают на водяной бане до небольшого объема. К упаренной жидкости по каплям прибавляют 8 %-й раствор соляной кислоты до кислой реакции (по лакмусу), а затем прибавляют 1 каплю 10 %-го раствора хлорида железа (III). Появление кроваво-красной окраски указывает на наличие цианидов в растворе. При взбалтывании окрашенного раствора с диэтило-вым эфиром окраска переходит в эфирный слой.
Предел обнаружения: 10 мкг синильной кислоты в 1 мл.
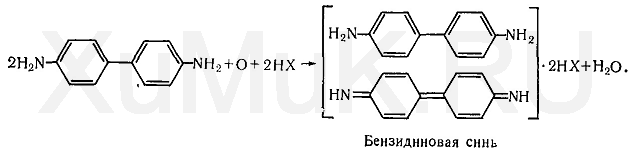
Реакция образования бензидиновой сини.Соли меди (II) с цианидами образуют дициан (CN) 2, при взаимодействии которого с водой выделяется кислород, окисляющий бензидин. Продуктом окисления бензидина является бензидиновая синь:
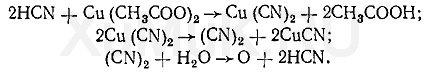
Выполнение реакции.Для выполнения этой реакции пользуются индикаторной бумагой, смоченной смесью растворов ацетата меди и бензидина.
В колбу вносят 2—3 мл исследуемого раствора, к которому прибавляют 1 мл 10 %-го раствора винной кислоты. Колбу сразу же закрывают пробкой, к которой прикреплена влажная индикаторная бумага. Затем колбу нагревают несколько минут на водяной бане. При наличии синильной кислоты или ее солей в пробе бумага синеет.
Приготовление индикаторной бумаги(см. Приложение 1, реактив 6).
Реакция с пикриновой кислотой.От прибавления пикриновой кислоты и щелочи к цианидам образуется соль изопурпуровой кислоты, имеющая красную окраску:
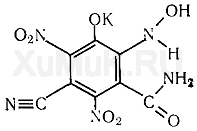
Выполнение реакции.К 1 мл щелочного дистиллята прибавляют 1 мл 0,5 %-го раствора пикриновой кислоты и слегка нагревают на водяной бане. При наличии цианидов раствор приобретает красную окраску. Подобную окраску с пикриновой кислотой дают и некоторые другие вещества (альдегиды, ацетон, сульфиты и др.). Поэтому реакция с пикриновой кислотой на цианиды имеет значение только при отсутствии цианидов в дистилляте.
Обнаружение цианидов методом микродиффузии.Синильную кислоту и ее соли можно обнаружить методом микродиффузии, который основан на реакции с пиридином и барбитуровой кислотой. Способ обнаружения цианидов методом микродиффузии описан выше (см. гл. III, § 3).
ФОРМАЛЬДЕГИД
Формальдегид (альдегид муравьиной кислоты)—газ, хорошо растворимый в воде, обладающий острым специфическим запахом. Водный раствор, содержащий 36,5—37,5 % формальдегида, называется формалином. Формальдегид образуется при неполном сгорании метана, при окислении метилового спирта и т. д. Газообразный формальдегид при комнатной температуре легко полимеризуется с образованием параформальдегида. Известно несколько продуктов полимеризации газообразного формальдегида. Один из полимеров формальдегида называется триоксиметилен (СН 2 О) 3. Он имеет температуру плавления 63—64°С. В водных растворах также образуется параформальдегид, относящийся к полиоксиметиленам, которые являются продуктами полимеризации значительно большего числа молекул формальдегида. ПараформаЛьдегид при нагревании, особенно в присутствии кислот, частично деполимеризуется с образованием газообразного формальдегида.
Формальдегид изолируют из биологического материала путем перегонки с водяным паром. Однако этим методом перегоняется только незначительная часть формальдегида. Считают, что формальдегид в водных растворах находится в виде гидрата (метиленгликоля), который трудно отгоняется с водяным паром:
НСНО + НОН ---> СН 2 (ОН) 2.
Применение. Действие на организм. Формальдегид широко используется в промышленности для получения пластических масс и фенолоформальдегидных смол, дубления кож, консервирования анатомических препаратов, получения гексаметилентетра-мина, синтетического каучука, протравливания зерна, обработки помещений, тары с целью дезинфекции.
Формальдегид проявляет дубящее, антисептическое и дезодорирующее действие., При вдыхании небольших количеств формальдегида он раздражает верхние дыхательные пути. При вдыхании больших концентраций формальдегида может наступить внезапная смерть в результате отека и спазма голосовой щели. При попадании формальдегида в организм через рот могут наступить некротические поражения слизистой оболочки рта, пищевого канала, появляется слюнотечение, тошнота, рвота, понос. Формальдегид угнетает центральную нервную систему, в результате этого может произойти потеря сознания, появляются судороги. Под влиянием формальдегида развиваются дегенеративные поражения печени, почек, сердца и головного мозга. Формальдегид оказывает влияние на некоторые ферменты. 60—90 мл формалина являются смертельной дозой.
Метаболизм. Метаболитами формальдегида являются метиловый спирт и муравьиная кислота, которые, в свою очередь, подвергаются дальнейшему метаболизму.
Дата добавления: 2016-06-29; просмотров: 3957;











