Растворение как физико-химический процес
Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией).
Растворение протекает с образованием различных по форме и прочности продуктов - гидратов. При этом участвуют силы как физической, так и химической природы. Процесс растворения вследствие такого рода взаимодействий компонентов сопровождается различными тепловыми явлениями.
Энергетической характеристикой растворения является теплота образованияраствора, рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо- и экзотермических стадий процесса. Наиболее значительными среди них являются:
– поглощающие тепло процессы - разрушение кристаллической решётки, разрывы химических связей в молекулах;
– выделяющие тепло процессы - образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение NaOH – экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na+ и OH-выделяется соответственно 422 и 510 кДж/моль.
Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH4NO3 наблюдается понижение температуры).
Растворимость
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях).
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.
Природа растворяемого вещества. Кристаллические вещества подразделяются на:
P - хорошо растворимые (более 1,0 г на 100 г воды);
M - малорастворимые (0,1 г - 1,0 г на 100 г воды);
Н - нерастворимые (менее 0,1 г на 100 г воды).
Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества - наоборот.
Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например,Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании.
Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается.

Влияние давления. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Благодаря неравномерному распределению электрического заряда в молекулах, т.е. наличию у нихотрицательных и положительных "полюсов" если говорить более строго - дипольного момента), даженейтральные в целом молекулы притягиваются друг к другу. Сила этого притяжения зависит от степенилокализации заряда и определяет способность жидкостей растворять различные вещества. Как правило,полярные молекулы достаточно сильно притягиваются друг к другу; именно поэтому спирт и вода легкосмешиваются. Взаимное притяжение неполярных молекул гораздо слабее. Примерами неполярныхсоединений служат тетрахлорид углерода CCl4 и углеводороды, например бензол.
Растворимость. Растворение начинается с того, что молекулы растворителя "прокладывают себе путь"между молекулами растворяемого вещества. Это может происходить только в том случае, если силыпритяжения между молекулами растворителя, с одной стороны, и растворителя и растворяемого вещества -с другой, примерно одинаковы. Отсюда следует правило растворимости: подобное растворяется в подобном(имеется в виду "подобное" по полярности). Вода и бензин не смешиваются, поскольку полярные молекулыводы сильно притягиваются друг к другу и молекулы углеводорода не могут проникнуть между ними. В то жевремя бензин легко смешивается с тетрахлоридом углерода, причем и тот, и другой служат хорошимирастворителями для многих нерастворимых в воде неполярных веществ, таких, как жиры или парафины.Вода, в свою очередь, растворяет большинство ионных веществ, например поваренную соль или питьевуюсоду (гидрокарбонат натрия NaHCO3), а также полярные неионные соединения, такие, как спирт, сахар(молекула которого содержит множество ОН-групп), крахмал и витамин С. Ни одно из этих веществ нерастворяется ни в бензине, ни в других углеводородах. При растворении ионных соединений в воде илидругих полярных растворителях ионы "вытягиваются" из кристаллической решетки силами притяжениямолекул растворителя:
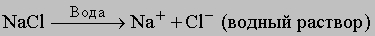 <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
при этом они сольватируются, т.е. более или менее прочно связываются с молекулами растворителя (вуравнении это не отражено), так что, например, ионы натрия находятся в виде Na+(H2O)x. Хорошорастворимый в воде газ хлороводород тоже диссоциирует на ионы водорода и хлорид-ионы:
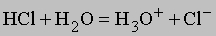 <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
Молекулы воды притягивают ионы водорода, и образуются ионы гидроксония Н3О+. Менее полярныесоединения (спирты или сахара и т.п.) в воде почти не диссоциируют. Иногда вещество начинаетрастворяться в результате химической реакции, которая изменяет его свойства. Так, мрамор (или известнякСаСО3) в чистой воде практически нерастворим, но растворяется в воде подкисленной:
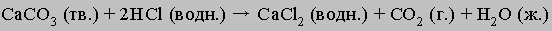 <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
Молекулы некоторых твердых веществ настолько прочно связаны друг с другом, что эти вещества нерастворяются ни в одном растворителе, за исключением тех, с которыми взаимодействуют химически. Вкачестве примеров можно привести алмаз, графит, стекло и песок.
Влияние температуры и давления. Растворимость жидкостей и твердых веществ обычно увеличиваетсяпри повышении температуры, поскольку при этом возрастает энергия движения (кинетическая энергия)молекул и уменьшается их взаимное притяжение. Изменение давления мало влияет на растворимость, таккак объем при растворении меняется незначительно. Гораздо больше давление влияет на растворимостьгазов. Газ лучше растворяется при увеличении давления, под действием которого часть его молекулпереходит в раствор. При повышении температуры растворимость газов снижается - кинетическая энергиямолекул возрастает, они быстрее движутся и легче "вырываются" из растворителя.
См. также РАСТВОРЫ.
Электролиты. Некоторые растворы, как и металлы, проводят электрический ток. В этом случае носителямизаряда служат ионы. Вещества, раствор которых проводит электрический ток, носят общее названиеэлектролитов, не проводящие - неэлектролитов.
См. также ЭЛЕКТРОЛИТЫ. Концентрация - это количество растворенного вещества, содержащееся вединице массы или объема раствора. Ее можно выразить в таких единицах, как, например, г/л (числограммов вещества в литре раствора). Иногда концентрацию измеряют в процентах. При этом необходимоуказывать, какие проценты имеются в виду: весовые или объемные. Например, 10%-ный раствор спирта вводе - это раствор, содержащий 10 объемов спирта и 90 объемов воды (объемные проценты), а 10%-ныйраствор хлорида натрия в воде - раствор, в котором на 10 массовых единиц вещества приходится 90массовых единиц воды (массовые проценты). Когда количество растворенного вещества очень мало,используют единицу "миллионная доля" - одна часть растворенного вещества на миллион частей раствора (ванглоязычной литературе ее обозначают ppm, в русской - м.д. или млн-1). Для описания химических реакцийудобнее выражать концентрацию в виде числа молекул или ионов растворенного вещества на единицуобъема раствора.
Моль. Моль - одна из семи основных единиц Международной системы единиц (СИ). Ее определяют какколичество вещества, которое содержит столько же атомов, молекул или ионов, сколько 12 г изотопауглерода 12С (см. выше), а именно 6,022*10 23 (число Авогадро). Понятие моля позволяет подсчитать,сколько частиц (атомов или молекул) вещества содержится в том или ином его массовом количестве.Например, из определения моля следует, что 6 г изотопа углерода 12С должны содержать 3,011*10 23атомов. Кроме того, из определения атомной массы известно, что количество граммов любого элемента,численно равное его атомной массе, содержит число Авогадро атомов этого элемента. Таким образом,4,0026 г гелия, 32,06 г серы и 200,59 г ртути содержат одинаковое число атомов соответствующего элемента,а именно 6,022*1023. Аналогично, для веществ, состоящих из молекул, моль вещества - это такое егоколичество, масса которого в граммах численно равна молекулярной массе вещества. Таким образом, мольхлора Cl2 имеет массу 35,453*2 = 70,906 г, моль хлорида натрия NaCl - (22,9898 + 35,453) = 58,443 г, а мольионов натрия Na+ - 22,9898 г.
Молярность. Молярность - это концентрация вещества в растворе, выраженная в молях растворенноговещества, содержащихся в 1 л раствора. Так, децимолярный (сокращенно 0,1 М) раствор хлорида натриясодержит 0,1 моль (или 5,8443 г) NaCl в 1 л раствора.
Моляльность. Моляльность - это число молей растворенного вещества в 1000 г растворителя. Так, 0,1-моляльный раствор хлорида натрия в воде содержит 0,1 моль (или 5,8443 г) NaCl в 1000 г Н2О. Эта единицаиспользуется реже, чем молярность.
Нормальность. Нормальность - это число эквивалентов вещества, содержащихся в 1 л раствора. Длясистем, в которые входят кислоты, основания и соли, эквивалент - это количество вещества, котороерасходуется при взаимодействии с 1 моль ионов водорода Н+. Например, при образовании моля сульфатанатрия Na2SO4 (1 моль = 142,0412 г) 1 моль серной кислоты теряет 2 моля Н+. Таким образом, 1 мольсульфата натрия содержит 2 эквивалента, и нормальность одномолярного раствора сульфата натрия равнадвум (2 н.).
Контрольные вопросы:
1. Какие смеси называют растворами?
2. Из каких компонентов состоят растворы?
3. Какие растворы называют насыщенными, ненасыщенными, разбавленными, концентрированными?
4. Может ли разбавленный раствор быть насыщенным?
5. Обязательно ли концентрированны раствор будет насыщенным?
6. Что означает массовая частичка?
7. Химическим или физическим является процесс растворения?
8. Какие существуют типы связей?
9. Почему вода является полярным растворителем?
10. Чем отличаются истинные растворы от дисперсных систем?
11. Где в жизни вы встречались с ратсворами?
Литература
1. Габриелян О.С. Химия. 9, 10, 11 кл. – М., 2000, 2003.
2. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014.
3. Габриелян О.С. Химия. Практикум: учеб. пособие. — М., 2014.
4. Габриелян О.С. и др. Химия. Тесты, задачи и упражнения: учеб. пособие. — М., 2014.
5. Габриелян О.С. Химия. Пособие для подготовки к ЕГЭ: учеб. пособие. — М., 2014.
6. Ерохин Ю.М. Химия: Задачи и упражнения: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
7. Ерохин Ю.М. Сборник тестовых заданий по химии: учеб. пособие для студ. Учреждений сред. проф. образования. — М., 2014.
8. Попель П.П., Крикля Л.С. Хімія: підручник для 10 класу загальноосвітніх навчальних закладів. – К.: ВЦ «Академія», 2010. – 208 с. : іл.
9. Попель П.П., Крикля Л.С. Хімія: підручник для 11 класу загальноосвітніх навчальних закладаів (академічний рівень). – К.: ВЦ «Академія, 2011. – 352 с. : іл.
10. Попель П.П., Крикля Л.С, Савченко І.О. Хімія: підручник для 11 класу загальноосвітніх навчальних закладів. – К.: ВЦ «Академія», 2007. – 272 с.
11. Савинкина Е.В., Логинова Г.П. Химия для школ и классов гуманитарного профиля. 10, 11 кл. – М., 2001-2002.
12. Химия: электронный учебно-методический комплекс. — М., 2014.
Дата добавления: 2020-05-20; просмотров: 832;











