Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом.
Не всегда обязательно вода является растворителем – существуют и неводные растворы. Однако когда речь идет о водных растворах, воду считают растворителем и в тех случаях, когда ее меньше. Например, говорят о 96%-ном растворе этилового спирта в воде, а не о 4 %-ном растворе воды в спирте.
** Существуют растворы не только жидкие, но и твердые. В твердых растворах частицы одного вещества хаотично распределены среди частиц какого-нибудь другого, но обязательно твердого вещества. Например, водород охотно растворяется в некоторых металлах (платине, палладии), и это пример твердого раствора. Смеси газов (например, воздух) не называют растворами. Дело в том, что важным свойством растворов является заметное взаимодействие между частицами растворителя и растворенных веществ, а в газах такое взаимодействие практически отсутствует.
Давайте разберемся в том, как происходит растворение веществ. Для этого понаблюдаем, как растворяется добавленный в чай сахар. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро.
Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют с молекулами воды межмолекулярные (водородные) связи. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя (рис. 7-2).
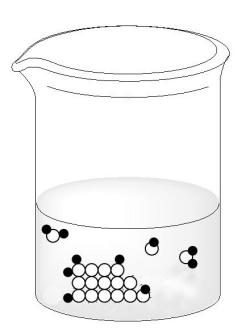
Молекулы сахара (белые кружочки), находящиеся на поверхности кристалла сахара, окружены молекулами воды (темные кружочки). Между молекулами сахара и воды возникают межмолекулярные связи, благодаря которым молекулы сахара отрываются от поверхности кристалла. Молекулы воды, не связанные с молекулами сахара, на рисунке не показаны.
 Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря тепловому движению. Это явление называетсядиффузией. Диффузия происходит медленно, поэтому около поверхности кристаллов находится избыток уже оторванных от кристалла, но еще не диффундировавших в раствор молекул сахара. Они мешают новым молекулам воды подойти к поверхности кристалла, чтобы связаться с его молекулами водородными или другими межмолекулярными связями. Если раствор перемешивать, то диффузия происходит интенсивнее и растворение сахара идет быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему. При растворении перманганата калия диффузию частиц в растворе можно наблюдать визуально благодаря интенсивной малиновой окраске этого вещества.
Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря тепловому движению. Это явление называетсядиффузией. Диффузия происходит медленно, поэтому около поверхности кристаллов находится избыток уже оторванных от кристалла, но еще не диффундировавших в раствор молекул сахара. Они мешают новым молекулам воды подойти к поверхности кристалла, чтобы связаться с его молекулами водородными или другими межмолекулярными связями. Если раствор перемешивать, то диффузия происходит интенсивнее и растворение сахара идет быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему. При растворении перманганата калия диффузию частиц в растворе можно наблюдать визуально благодаря интенсивной малиновой окраске этого вещества.
Растворение веществ можно сравнить с перетаскиванием мебели. Представьте, что на время ремонта школьные столы (или парты) составили в спортзале в строгом порядке аккуратным штабелем. Этот упорядоченный штабель является моделью кристаллического вещества, а каждый стол – как бы "молекулой" такого вещества. После окончания ремонта учеников попросили помочь перетащить столы. В спортзал вбежала ватага учеников (эта ватага не что иное, как растворитель, а каждый ученик – молекула растворителя), кто-то залез наверх, кто-то тянет столы снизу – короче, работа закипела. Очень скоро столы, каждый из которых несут где двое, а где четверо ребят, оказываются в разных концах школы, а от штабеля в спортзале не остается и следа.

Количество молекул, способных перейти в раствор, часто ограничено. Молекулы вещества не только покидают кристалл, но и вновь присоединяются к кристаллу из раствора. Пока кристаллов относительно немного, больше молекул переходит в раствор, чем возвращается из него – идет растворение. Но если растворитель находится в контакте с большим количеством кристаллов, то число уходящих и возвращающихся молекул становится одинаковым и для внешнего наблюдателя растворение прекращается.
Например, при комнатной температуре мы не можем растворить в 100 мл воды более 200 г сахара или более 35,9 г поваренной соли. В таких случаях говорят, что раствор стал насыщенным.
Дата добавления: 2020-05-20; просмотров: 837;











