КРИСТАЛЛИЗАЦИЯ СЛИТКА
При охлаждении металла, разлитого в изложницы, кристаллизатор или форму, наступает момент, когда температура жидкого металла снижается до температуры его плавления (температуры кристаллизации). При этом создаются условия, необходимые для кристаллизации металла. Температура плавления стали зависит от ее состава и колеблется в достаточно широких пределах (табл. 24.1). Характер влияния изменения температуры на изменение свободной энергии жидкого и твердого металла различен (рис. 24.1).
Таблица 24.1.Изменение характеристик*
сплава железа при введении в него 1 %
некоторых элементов
| Элемент | Д/, "C | Коэффициент и степень ликвации | ||
| К | \-К | |||
| 5-Fe | 5-Fe | Y-Fe | ||
| S | 0,02 | 0,98 | 0,98 | |
| 0,02 | 0,98 | 0,98 | ||
| в | 0,05 | 0,95 | 0,96 | |
| р | 0,13 | 0,87 | 0,94 | |
| с | 0,13 | 0,87 | 0,64 | |
| Ti | 0,14 | 0,86 | 0,93 | |
| N | — | 0,28 | 0,72 | 0,46 |
| н | — | 0,32 | 0,68 | 0,55 |
| Си | 0,56 | 0,44 | 0,12 | |
| Si | 0,66 | 0,34 | 0,50 | |
| Mo | 0,80 | 0,20 | 0,40 | |
| Ni | 3,5 | 0,80 | 0,20 | 0,05 |
| Mn | 0,84 | 0,16 | 0,05 | |
| Co | 1,8 | 0,90 | 0,10 | 0,05 |
| V | 0,90 | 0,10 | ___ | |
| Al | 0,92 | 0,08 | ___ | |
| W | <1 | 0,95 | 0,05 | 0,50 |
| Cr | 0,95 | 0,05 | 0,15 |
*Δt — снижение температуры плавления при введении 1 % элемента; К— соотношение концентраций элемента в твердой и жидкой фазах, К = СТВ/СЖ (зависит от взаимного расположения линий ликвидуса и солидуса). С увеличением разности (1 — К) степень ликвации повышается. Следует обратить внимание на высокую склонность к ликвации таких элементов, как сера, кислород, фосфор.________________________________
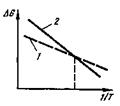
Рис. 24.1.Влияние температуры на изменение свободной энергии жидкого (/) и твердого (2) тел
При снижении температуры наступает момент, которому соответствует пересечение линий, характеризующих это влияние. При дальнейшем понижении температуры свободная энергия упорядоченного твердого тела становится ниже, чем жидкости. Соответственно термодинамически более стабильной становится твердая фаза.
24.1.1. Кристаллизация стали.Сталь, как и все металлы, при затвердевании образует обычно кристаллы, т. е. твердые тела, имеющие упорядоченное расположение атомов1. Образование зародыша кристалла сопряжено с увеличением энергии Гиббса, связанным с затратой энергии на создание новой поверхности раздела между зародышем кристалла и жидкостью. При образовании зародыша новой фазы, в данном случае кристаллов металла, атомы или молекулы кристаллизующегося металла объединяются в кристаллические агрегаты. Объединение частиц в агрегат (т. е. кристаллизация) уменьшает энергию Гиббса системы, а появление новой поверхности — увеличивает. Чем меньше размеры образовавшегося агрегата (кристалла), тем большая доля его частиц лежит на поверхности и тем большая роль поверхностной энергии. Поэтому с увеличением размера зарождающегося кристалла работа (затраты энергии), совершаемая для его образования, вначале возрастает, а затем снижается (рис. 24.2). Размеры кристалла, для которого работа обра-
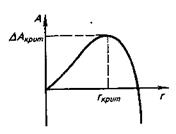
Рис. 24.2.Зависимость работы А, совершаемой для образования кристаллического агрегата, от размеров г зародыша
зования максимальна, называют критическими, а сам зародыш кристалла — критическим зародышем. Обычно для простоты принимают, что конфигурация образующегося при этом зародыша близка к шарообразной, и размер зародыша характеризуют условным радиусом такого шара, называя его критическим радиусом или радиусом критического зародыша. Чем меньше энергия, которую необходимо затратить для образования зародыша (чем меньше работа образования зародыша), тем вероятнее его появление. Условия зарождения существенно улучшаются, если имеется готовая поверхность раздела фаз. Этим объясняется преимущественное зарождение частиц твердой фазы на посторонних частицах (например, на твердых частицах тугоплавких неметаллических включений) или на поверхностях твердых тел (например, на поверхности изложницы или кристаллизатора).
1В исключительных условиях, при сверхбыстром охлаждении, при затвердевании металлов может наблюдаться неупорядоченное расположение атомов (так называемые аморфные металлы): при низких температурах подвижность частиц жидкости резко снижается и становится столь малой, что расплав, твердея, остается аморфным, как жидкость или стекло.
Для начала кристаллизации необходимо определенное переохлаждение жидкости. При отсутствии готовых поверхностей, улучшающих условия образования новой фазы, это переохлаждение должно быть значительным. Гомогенное зарождение в объеме чистой жидкости возможно лишь при очень глубоких переохлаждениях. В частности, для капель чистого железа при отсутствии их контакта с твердой фазой получено переохлаждение -300 °С. Однако в реальных условиях плавки и разливки больших масс металла имеют дело с так называемым гетерогенным зарождением кристаллов, т. е. со случаем, когда, во-первых, в металле имеется определенное число находящихся во взвешенном состоянии частиц неметаллических включений и, во-вторых, металл при кристаллизации находится в контакте с холодной шероховатой поверхностью изложницы или кристаллизатора. В реальных условиях разливки стали ее переохлаждение при кристаллизации экспериментально зафиксировать трудно. Практически в момент соприкосновения жидкого металла с твердыми стенками кристаллизатора (изложницы) в зонах этого соприкосновения (т. е. у стенок) имеют место спонтанное массовое появление зародышей и их рост.
24.1.2. Образование зоны столбчатых кристаллов.В момент зарождения кристаллов в тонком слое, непосредственно прилегающем к стенкам кристаллизатора (изложницы), зародыши на стенках ориентированы хаотично, однако в процессе роста «выживают» те из них, у которых направление максимальной скорости роста перпендикулярно холодной стенке (соответствует направлению отвода тепла или направлению охлаждения). В результате уже на небольшом расстоянии от поверхности возникает так называемая зона столбчатых кристаллов, состоящая из почти параллельных узких кристаллов, вытянутых перпендикулярно к поверхности. Протяженность и характер этой зоны зависят от следующих факторов.
1. Интенсивность отвода тепла (чем выше интенсивность отвода тепла, тем мельче кристаллы).
2. Степень перегрева расплава (чем выше перегрев, тем крупнее кристаллы; для получения мелкозернистой структуры необходима малая степень перегрева).
3. Соотношение перегрева и интенсивности охлаждения (при интенсивном отводе тепла и одновременно при сохранении середины слитка в жидком состоянии можно добиться получения слитка, целиком состоящего из столбчатых кристаллов).
4. Наличие конвекционных или искусственно вызываемых потоков в жидкости, которые могут обламывать ветви растущих кристаллов (дендритов).
5. Присутствие в жидкости твердых взвешенных частиц неметаллических включений, которые могут являться дополнительными центрами кристаллизации на некотором расстоянии от растущих столбчатых кристаллов (чем больше таких частиц, тем меньше зона столбчатых кристаллов и меньше их размеры).
6. Содержание в металле поверхностно-активных примесей, которые адсорбируются на поверхности раздела кристалл-жидкий металл и препятствуют росту кристаллов, или искусственное введение в металл таких поверхностно-активных компонентов. Технологический прием, при котором в металл вводят поверхностно-активные примеси, называют модифицированием. Элементы, вызывающие измельчение кристаллической структуры сплава как поверхностно-активные примеси, адсорбирующиеся из расплава на границе кристалл—расплав, называют модификаторами I рода1.
'Вещества, вводимые в жидкий металл для получения мелкозернистой структуры, называют также инокуляторами (от лат. inoculatio — прививка). Слово модификатор происходит от позднелат. modifico — видоизменять, изменять форму. Классификация модификаторов на две группы была принята по предложению акад. П. А. Ребиндера.
7. Искусственное введение в металл зародышей в виде, например, частиц порошка железа или частиц тугоплавких оксидов. Частицы, вызывающие измельчение структуры в результате искусственного увеличения числа зародышей кристаллизации, называют модификаторами IIрода. Воздействие металлических порошков на структуру является и затравочным, и модифицирующим. При полном расплавлении порошка остаются активные примеси, которые были в нем, и снимается значительная часть перегрева стали, что, несомненно, способствует более глубокому переохлаждению стали на границе затвердевания. Если частица не расплавилась, то она является готовым центром кристаллизации. Данную технологию иногда называют суспензионной разливкой.
8. Искусственное измельчение кристаллов путем механического или физического воздействия (встряхивания изложницы, вибрации, воздействия ультразвуком).
Растущие в направлении отвода тепла кристаллы имеют разветвленную форму (форму дендритов2). Эту стадию кристаллизации часто так и называют дендритной кристаллизацией. Дендритное строение кристаллов в слитке было выявлено известным русским металлургом Д. К. Черновым еще в 1868 г. В дендрите различают ветви (или оси) 1-, 2- и 3-го порядков. Рост дендритов в длину (т. е. по оси, совпадающей с направлением отвода тепла) происходит со скоростью, во много раз (до 100) превышающей скорость роста дендритов в поперечном направлении.
2 От греч. dendron — дерево. Это кристаллическое образование типа скелетных кристаллов, взаимно ориентированных в соответствии с их симметрией.
24.1.3. Скорость кристаллизации слитка,т. е. увеличение во времени толщины закристаллизовавшегося слоя, зависит от поперечного сечения слитка (т. е. от его массы), разности температур разливаемой стали и изложницы, а также скорости отвода тепла изложницей или кристаллизатором. Между толщиной закристаллизовавшегося слоя металла s и продолжительностью кристаллизации т установлено соотношение s = k 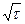 , где k — эмпирический коэффициент, значение которого в зависимости от условий затвердевания слитка находится в пределах 2,3—3,0 см/мин1/2. Это соотношение часто называют формулой квадратного корня.
, где k — эмпирический коэффициент, значение которого в зависимости от условий затвердевания слитка находится в пределах 2,3—3,0 см/мин1/2. Это соотношение часто называют формулой квадратного корня.
24.1.4. Явления, сопутствующие кристаллизации.Кристаллизующаяся сталь всегда содержит большее или меньшее количество примесей, которые являются причиной образования ряда дефектов. В реальных кристаллах всегда имеет место неоднородное распределение примесей. Примесь изменяет параметры решетки, и на границах областей разного состава возникают внутренние напряжения. Это приводит к образованию дислокаций и трещин. Дислокации при кристаллизации возникают и как результат упругих напряжений в неравномерно нагретом кристалле, а также при нарастании более горячих новых слоев на более холодную поверхность. В стали всегда содержатся газы (водород, азот), растворимость которых в твердом металле существенно ниже, чем в жидком. Соответственно при кристаллизации растворимость газов резко снижается и сверхравновесные количества газов выделяются на фронте растущих кристаллов. При большой скорости кристаллизации пузыри этих газов могут захватываться растущим кристаллом. Также захватываются и посторонние твердые частицы из маточной среды; все они становятся затем источниками внутренних напряжений в кристалле.
Кристаллизация стали сопровождается явлением ликвации1 содержащихся в ней примесей. Ликвация возникает в результате того, что сталь в отличие от чистого железа кристаллизуется не при определенной температуре, а в интервале температур. При этом состав кристаллов, образующихся в начале затвердевания, может существенно отличаться от состава последних порций кристаллизующегося маточного раствора. Чем шире температурный интервал кристаллизации сплава, тем большее развитие получает ликвация. Наибольшую склонность к ликвации (склонность ликвировать) проявляют те компоненты сплава, которые наиболее сильно влияют на ширину интервала кристаллизации. Явление ликвации примесей при кристаллизации стального слитка было впервые обнаружено в 1866г. русскими металлургами Н. В. Калакуцким и А. С. Лавровым.
В соответствии с диаграммой состояния данного сплава растворимость той или иной примеси (углерода, серы и т. д.) изменяется при изменении температуры. Обычно растворимость примесей при снижении температуры уменьшается; это прежде всего важно в отношении к таким элементам, которые в большем или меньшем количестве имеются в каждой стали (углерод, сера, фосфор). Все эти элементы имеют ограниченную растворимость в железе в твердом состоянии.
Изучая диаграммы состояния Fe-C, Fe-S, Fe-P и др., можно для данных исходных концентраций углерода, серы, фосфора и других элементов проследить, как изменяется состав расплава при понижении температуры. По мере понижения температуры остающийся незатвердевшим расплав становится все более загрязнен примесями (их часто называют ликватами), в то время как первые порции закристаллизовавшегося металла относительно чисты (явление образования вначале чистых по составу кристаллов называют избирательной кристаллизацией). При очень высоких скоростях охлаждения металл затвердевает настолько быстро, что явление ликвации проявляется слабо и состав металла однороден. При уменьшении скорости затвердевания явление ликвации примесей становится заметным. Например, кристаллизующиеся в первую очередь оси дендритов чище, чем застывающий в последнюю очередь маточный раствор, находящийся в пространстве между дендритами.
Если разрезать закристаллизовавшийся слиток и протравить поверхность разреза в зоне столбчатых кристаллов, то можно увидеть относительно чистые оси дендритов и более загрязненные (и хорошо растворяющиеся при травлении) участки между осями. Это проявилась так называемая дендритная ликвация. По мере роста зоны столбчатых кристаллов усиливается различие в составе стали в относительно чистой зоне растущих кристаллов и в более загрязненной маточным раствором; находящимся в центре слитка и кристаллизующимся в последнюю очередь. Ликваты легче чистого железа; они всплывают в верхнюю часть слитка. Явление различия в составе отдельных зон слитка получило название зональная ликвация или сегрегация1. Растворимость газов при кристаллизации уменьшается, поэтому процесс ликвации примесей сопровождается процессом газовыделения. Поднимающиеся пузыри газа перемешивают металл и одновременно увлекают с собой металл с повышенным содержанием ликватов. В большинстве случаев межфазное натяжение на границе газ (газовый пузырь)—включение  г-вклменьше межфазного натяжения на границе металл—включение
г-вклменьше межфазного натяжения на границе металл—включение 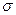 м-вкл, т. е.
м-вкл, т. е. 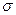 г.вкл <
г.вкл < 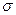 м.вкл. Это означает, что включение лучше смачивается газом (прилипает к нему), чем металлом. Таким образом, столб поднимающихся газовых пузырьков увлекает скопления различных ликватов и загрязнений. Если разрезать затвердевший слиток и исследовать его внутреннюю часть, то можно обнаружить следы этого подъема в виде полос загрязненного ликватами металла, так называемая Л-образная ликвация или «усы». Форма ликвационных полос (рис. 24.3) зависит от состояния процессов кристаллизации, газовыделения и движения металла в изложнице.
м.вкл. Это означает, что включение лучше смачивается газом (прилипает к нему), чем металлом. Таким образом, столб поднимающихся газовых пузырьков увлекает скопления различных ликватов и загрязнений. Если разрезать затвердевший слиток и исследовать его внутреннюю часть, то можно обнаружить следы этого подъема в виде полос загрязненного ликватами металла, так называемая Л-образная ликвация или «усы». Форма ликвационных полос (рис. 24.3) зависит от состояния процессов кристаллизации, газовыделения и движения металла в изложнице.
Для характеристики тенденции данного элемента к ликвации (возможной степени ликвации) часто используют коэффициент ликвации К (см. табл. 24.1). Ликвация может быть тем больше, чем меньше численное значение коэффициента К, т. е. чем больше разность 1 — К. Ликвация может происходить только в тех случаях, когда при температуре, соответствующей затвердеванию, содержание примесей больше, чем максимальная растворимость в твердом растворе.
В качестве примера расчета рассмотрим верхний левый угол диаграммы Fe-C (рис. 24.4). В области 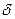 -Fe для случая жидкой стали с содержанием 0,075 % С (точка Н) концентрация углерода в затвердевающей последней капле жидкости в соответствии с диа-
-Fe для случая жидкой стали с содержанием 0,075 % С (точка Н) концентрация углерода в затвердевающей последней капле жидкости в соответствии с диа-
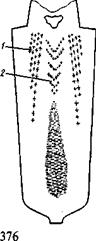
Рис. 24.3.Схема ликвации в слитке спокойной стали:
/—Л-образная ликвация; 2 — V-образная; (++) — зона положительной ликвации; (----) — зона отрицательной ликвации

Рис. 24.4.Верхняя часть диаграммы Fe-C
граммой состояния равна 0,59 %, откуда коэффициент ликвации для углерода К= 0,075 : 0,59 = 0,13; (1 - К) = 1 - 0,13 = 0,87. Величина (1 - К) характеризует тенденцию углерода к ликвации в железе. На основе данных о значении (1 — К) для ряда элементов, приведенных в табл.^4.1, углерод, сера, фосфор имеют большую склонность к ликвации.
Степень ликвации примесей в слитке колеблется в широких пределах — в зависимости от продолжительности процесса затвердевания слитка, интенсивности его охлаждения и перемешивания жидкого металла в течение всего периода затвердевания. Чем выше интенсивность охлаждения, меньше продолжительность затвердевания и ниже интенсивность перемешивания, тем в меньшей мере успевают развиться ликвационные явления.
Степень ликвации определяют разными способами, но чаще всего на основе анализа проб металла в отдельных зонах слитка и определения разности максимальной концентрации данного компонента (данной примеси) Cmax в какой-то зоне слитка и минимальной в другой зоне Cmin, т. е. Cmax — Cmin Значение этой разности относят к
Cmin или к Сковш, т.е. концентрации данного компонента в ковшовой пробе: [(Cmax – Сmin)/Cmin] • lOO % или [(Сmах – Сmin)/Сковш] • 100 %.
В тех случаях, когда определяют степень ликвации в отдельной зоне слитка, степень ликвации рассчитывают по уравнению [(С3 - Cковш)/Оковш] •100 %, где С3 — концентрация данного компонента в данной зоне. Рассчитанная по этой формуле степень ликвации может быть положительной и отрицательной. Обычно в средней и верхней частях слитка ликвация положительная, т. е. наблюдается повышенное содержание ликвирующих примесей. В нижней части слитка часто наблюдается отрицательная ликвация.
Большая чистота металла в нижней части слитка объясняется одновременным влиянием следующих двух факторов:
1. Ускоренным охлаждением металла вследствие охлаждающего воздействия массивного металлического поддона и отсутствия малотеплопроводного воздушного зазора между поддоном и дном стоящего на поддоне слитка.
2. Опусканием более плотных (по сравнению с жидким металлом) твердых кристаллов. Плотность твердого металла выше, чем жидкого, и обломившиеся под воздействием конвективных потоков жидкости концы ден-дритов медленно опускаются на дно слитка. В результате их падения в нижней части слитка образуется так называемый конус осаждения. Поскольку оси растущих кристаллов чище, чем маточный раствор, металл в зоне конуса осаждения обычно чище. Однако в тех случаях, когда для ускорения кристаллизации и измельчения структуры в металл вводят модификаторы, при взаимодействии которых с растворенным в металле кислородом образуются тугоплавкие оксиды, в донной части слитка могут наблюдаться скопления этих оксидов (они были центрами кристаллизации и опустились вместе с кристаллами в нижнюю часть слитка).
24.1.5. Явления усадки при кристаллизации. При затвердевании слитка наблюдается явление, связанное с различием плотностей жидкой и твердой стали. При охлаждении стали ее объем несколько уменьшается, однако наиболее заметное уменьшение объема происходит в момент перехода из жидкого в твердое состояние. Уменьшение линейных размеров и объема стали при переходе из жидкого в твердое состояние называют усадкой. Различают линейную и объемную усадку. Если обозначить соответствующий размер изложницы или кристаллизатора l1, объем V1, а размер слитка после затвердевания — l2 и объем V2, то величину [(l1 –l2)/l2] •100 % называют линейной усадкой; соответственно величину [(V1 - V2)/V 2] •100 % называют объемной усадкой. Процесс усадки стали при ее кристаллизации существенно влияет на ход формирования структуры слитка и на его качество. Так, вскоре после наполнения изложницы, во время образования столбчатых кристаллов доля затвердевшего металла (относительно всей массы слитка) становится уже заметной. Поскольку объем затвердевшего металла меньше объема, который занимал жидкий металл, общий объем кристаллизующегося слитка уменьшается. Практически это выражается в том, что между изложницей и слитком образуется воздушный зазор. В свою очередь, образование зазора приводит к резкому (в 3—5 раз) снижению интенсивности теплоотвода, замедляет процесс кристаллизации слитка и т. п. С явлением усадки связаны температурные и усадочные напряжения, склонность к трещинообразованию и др. Усадка при затвердевании слитка зависит от состава стали, прежде всего от содержания углерода, и увеличивается с ростом интервала кристаллизации:
Содержание углерода, % 0,10 0,35 0,45 0,70
Уменьшение объема стали при затвердевании, % 2,0 3,0 4,3 5,3
Объем затвердевшего и остывшего слитка VXOJI меньше объема залитого в изложницу или кристаллизатор жидкого металла Vг°р на величину, складывающуюся из уменьшения объема при охлаждении жидкого металла Vохлж, величины усадки при переходе из жидкого в твердое состояние Vус и уменьшения объема при охлаждении затвердевшего горячего слитка до нормальной температуры Vохлтв , т. е.
Vг°р - VXOJI = Vохлж + Vус + Vохлтв
Решающее влияние на разность Vг°р - VXOJI оказывает усадка Vус. На линейные размеры слитка после усадки влияет процесс газовыделения при кристаллизации. Часть выделяющихся газов не успевает выделиться и остается в слитке, увеличивая его объем. Поэтому объемную усадку можно рассчитать, зная точно, какой объем застывшего слитка занимают газы. Для грубых подсчетов можно принять, что объемная усадка слитка составляет 3,0-3,5%.
Таким образом, кристаллизация стали в слитки сопровождается рядом процессов, таких, как ликвация, выделение газов, всплывание включений, усадка и т. д. Все эти процессы влияют на строение формирующегося слитка и качество металла. Кроме того, строение слитка зависит от состава стали (спокойная, кипящая, полуспокойная сталь) и от способа разливки (в изложницу сверху, сифоном, непрерывный).
Исследования процессов кристаллизации проводили и проводят тысячи ученых во всем мире. Напомним о роли нашего соотечественника Д. К. Чернова. Опубликованная в 1878г. работа Д. К. Чернова «Исследования, относящиеся до структуры литых стальных болванок», подытожила все, что было известно ранее по этому вопросу и дала исчерпывающе ясную теорию формирования слитка. Д. К. Чернов впервые доказал, что сталь является кристаллическим телом; дал общепринятую в настоящее время схему структурных зон слитка; основал теорию последовательной кристаллизации; объяснил механизм образования усадочных раковин и рыхлости, трещин, газовых пузырей, внутренних напряжений, дендритной структуры; изучил и сопоставил свойства литого и кованого металла; высказал соображения о периодической кристаллизации стали.
Дата добавления: 2016-06-22; просмотров: 4362;











