КРИСТАЛЛИЗАЦИЯ И РАСТВОРЕНИЕ
Кристаллизация — разделение однородных жидких растворов на твердую и жидкую фазы: растворенное вещество и растворитель. Выпадение кристаллов из растворов может быть либо полезным процессом пищевого производства, в частности, завершающей стадией сахаро-песочного, лимонно-кислотного, глюкозного и других процессов, либо процессом, который необходимо блокировать, в частности, в производстве карамели, при охлаждении молока после сгущения и др.
Растворение — образование однородной системы (раствора) из твердого вещества и жидкого растворителя без формирования остаточной пористой структуры, называемой шламом. Если в результате взаимодействия твердого тела с жидким растворителем остаются пористые тела (скелет) или нерастворимый осадок (шлам), то такой процесс называют выщелачиванием. Выщелачивание включает как минимум два процесса — диффузию вещества в порах шлама и его переход в жидкость на поверхности.
Перекристаллизация — чередование процессов кристаллизации и растворения. Перекристаллизацию часто применяют для очистки продукта.
Растворение кристаллов в жидкости включает следующие процессы:
отрыв отдельных молекул от поверхности кристаллов в результате флуктуации собственного колебательного (осциллирующего) движения и вследствие притяжения молекулами растворителя;
диффузия оторвавшихся молекул в объеме растворителя;
обратный переход молекул твердого вещества из раствора в кристаллы при соударениях с ними.
При повышении концентрации молекул растворимого вещества в растворителе первый из этих процессов замедляется, а последний ускоряется, так как движущей силой обоих процессов является разность концентраций растворяемого вещества на поверхности кристалла и в растворе, которая при этом уменьшается. Поэтому при достижении некоторой концентрации в растворе, называемой равновесной, оба эти процесса уравновешиваются по скорости и дальнейшее изменение концентрации прекращается. Такой раствор называют насыщенным. Растворы с большей концентрацией называют концентрированными, или пересыщенными, а с меньшей - разбавленными.
Концентрацию растворенного вещества в равновесном (насыщенном) растворе называют растворимостью. Она выражается разными величинами: относительной массой растворенного вещества, молярной его долей в растворе и т. п. Степень отклонения раствора от состояния насыщения характеризуется коэффициентом пересыщения П, являющемся отношением концентрации растворенного вещества С к растворимости С0:
П=С/С0.
На растворимость веществ существенно влияют примеси и температура среды.
Для выделения растворенного вещества из раствора необходимо создать условия для его пересыщения. Это достигается кристаллизацией в процессе:
сгущения раствора путем выпаривания растворителя при постоянной температуре кипения (изотермическая);
охлаждения раствора, понижающем растворимость (изогидрическая, т. е. протекающая при постоянном количестве растворителя);
связывания растворителя химическими способами («высаливание»).
Если в процессе выпаривания растворителя его убыль восполняется поступлением свежего раствора, то такой процесс называют изотермически-изогидрическим.
В реальных процессах кристаллизация практически никогда не начинается при значениях параметров, соответствующих насыщенному раствору. Вблизи этих значений параметров выделяется
область метастабильного раствора (предшествующего стабильному), отделяющая область стабильного (разбавленного) раствора от области лабильного (неустойчивого) пересыщенного раствора. Это иллюстрируется рисунком 39.1 в координатах концентрация растворенного вещества С — температура t. Метастабильная зона концентраций ограничена на этом рисунке кривыми растворимости Со и максимально достижимым пределом пересыщения Сmах.
При достижении максимальной концентрации Сmах самопроизвольно начинается спонтанно протекающая кристаллизация. Растворы с концентрацией, превышающей предельную, называют лабильными. В эти представления могут быть внесены поправки, связанные с наличием в растворах примесей.
На рисунке 39.1 изображены процессы изменения состояния растворов. Ненасыщенный раствор, характеризующийся точкой А (С1, Сt), вначале охлаждается при С = const, т. е. по горизонтальной линии АВН и при изменении температуры от t1 до t2.
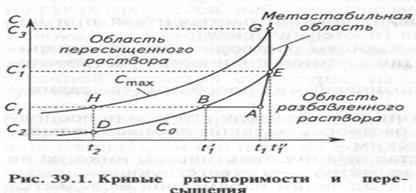
При температуре t1 линия этого процесса пересекает линию насыщения, однако выпадения кристаллов не наблюдается вплоть до температуры t2. Начавшись в точке Н, процесс кристаллизации протекает по линии HD, т. е. при t = const, и проходит до достижения концентрации С2 на кривой растворимости при t = t2
Процесс кристаллизации с выпариванием изобразится на этом рисунке линией AEG, состоящей из участка АЕ повышения температуры до точки кипения t" (до достижения концентрации С1), и участка EG повышения концентрации путем выпаривания до начала кристаллизации (до С3). После начала кристаллизации процесс либо остается постоянно соответствующим состоянию точки G (если ведется подпитка свежим раствором), либо вновь возвращается к точке Е, если выпаривание прекращается.
Обобщенной действующей силой процесса кристаллизации является разность фактической концентрации ΔС пересыщенного раствора Сп.р и концентрации, лежащей на кривой насыщения Сн:
ΔС = СП.р -Сн.
Массовый поток кристаллов (кг/с) можно связать с движущей силой выражением
ΔМ = FKΔC,
где F— площадь поверхности кристаллов в рассматриваемый момент времени, м2; К— феноменологический коэффициент интенсивности кристаллизации, кг/(м2с); ΔС —разность концентраций, моль/моль.
Основные положения
1. Кристаллизация — разделение однородных жидких растворов на твердую и жидкую фазы. Растворение - обратный процесс - образование однородного раствора из твердой и жидкой фаз в процессе растворения.
2. Кристаллы выпадают из пересыщенного раствора. Способы пересыщения: выпаривание, охлаждение и высаливание. В процессе пересыщения увеличивается обобщенная движущая сила кристаллизации - разность концентраций фактического и насыщенного растворов. При достижении критического ее значения процесс кристаллизации начинается самопроизвольно и продолжается до достижения концентрации насыщения. Процесс кристаллизации можно инициировать и раньше, но для этого требуется создать в растворе зародыши кристаллов.
3. Пребывание раствора в пересыщенном состоянии сопровождается одновременным протеканием двух процессов: образования зародышей кристаллов и их растворения. Зародыши образуются при сближении двух или нескольких молекул растворенного вещества вследствие удержания их силами притяжения. Они растворяются в результате ударов по зародышам других молекул и отрыва от них части молекул кристалла. Мелким зародышам, состоящим из 3...10 молекул, удары могут быть нанесены в более опасных направлениях, способствующих отрыву. Это усиливает растворение. Если кристаллы более крупные, то такие удары невозможны.
4. Процесс кристаллизации можно представить как два последовательно протекающие процесса: диффузия молекул к кристаллу и их осаждение на поверхности. Торможение любого из этих процессов блокирует кристаллизацию в целом. Для его блокирования обычно используют торможение диффузии путем охлаждения утфеля. Интенсифицирует диффузию нагревание и перемешивание утфеля.
5. Аппараты для кристаллизации бывают периодического и непрерывного действия. Отдельные стадии процесса, например выпадения кристаллов из утфеля, могут выполняться в отдельных аппаратах. Основное требование к кристаллизаторам: возможность большого уваривания массы и надежная циркуляция утфеля. Для выполнения этих требований применяют специфичные формы рабочих объемов теплообменников: расширенная нижняя часть, крупные кипятильные трубы (не менее 85 мм в диаметре), предельно низко опущенные поверхности нагрева.
6. Расчеты кристаллизаторов включают решение уравнений материального и энергетического балансов. Предварительно изображают схему аппарата, на ней стрелками указывают потоки вещества.
Дата добавления: 2016-06-29; просмотров: 4790;











