КИНЕТИКА ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Учение о скоростях. Любая химическая реакция характеризуется, кроме принципиальной возможности ее протекания (обусловленной законами термодинамики), скоростью процесса. Скорость ферментативной реакции - изменение [S] или [P] в единицу времени. Измерив ее скорость, то есть скорость в присутствии фермента, мы должны измерить скорость реакции и в отсутствии фермента (спонтанно протекающая реакция). Именно эта разность и характеризует работу фермента.
ИЗМЕРЯЯ СКОРОСТЬ РЕАКЦИИ, ВСЕГДА НАДО ИЗМЕРЯТЬ НАЧАЛЬНУЮ СКОРОСТЬ ПРОЦЕССА, то есть скорость ферментативной реакции, в достаточно короткий промежуток времени, когда концентрация субстрата меняется, не настолько значительно, чтобы это отразилось на скорости процесса. Единицы измерения скорости реакции могут быть разными. Лучше пользоваться молярными единицами, а время - это минуты или секунды, реже часы. Поэтому скорость реакции может выражаться, например, в мкмоль/мин или ммоль/час. Величина скорости определяется законом действующих масс. В общем случае скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. В случае ферментативной кинетики - одно из реагирующих веществ - фермент, концентрация которого на много порядков МЕНЬШЕ, чем концентрация субстрата. Это определяет некоторые особенности кинетики ферментативного катализа.
V = k+2. [E].[S]
1. ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ ФЕРМЕНТА ([E]) при постоянной и довольно большой концентрации субстрата ([S]>>[E], [S]=const) имеет такой вид:
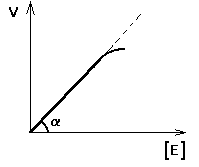
|
Отклонение от линейности графика при очень высокой концентрации фермента возникает из-за нехватки субстрата, поэтому снижается скорость поступления субстрата на активный центр фермента. Определять скорость ферментативной реакции надо только в том диапазоне концентраций фермента, в котором график линеен.
Линейность этого графика позволяет выразить его одной цифрой - тангенс угла наклона к оси абсцисс. Этот тангенс представляет собой величину активности фермента. Именно работа (эффективность) каждого фермента количественно характеризуется величиной его активности, то есть величиной скорости ферментативной реакции в расчете на единицу количества фермента. Единицы активности могут быть различными: мкмоль S/мин.мг или мкмоль S/мин.мл сыворотки крови.
МОЛЕКУЛЯРНАЯ АКТИВНОСТЬ - это количество молекул субстрата, которые превращаются одной молекулой фермента за одну минуту при 30оС и прочих оптимальных условиях. Преимущество этой единицы - в том, что можно сравнивать не только активность ферментов из разных источников, но и эффективность разных ферментов. Например, молекулярная активность фермента каталазы составляет 5*106, а карбоангидразы - 36*106.
Из линейности графика следует, что по скорости реакции можно судить о количестве фермента.
КАТАЛ - это количество фермента, которое обеспечивает превращение 1 моля субстрата за 1 секунду.
ЮНИТ - это количество фермента, которое превращает 1 мкмоль субстрата за 1 минуту. 1 Юнит = 16,67 нкатал
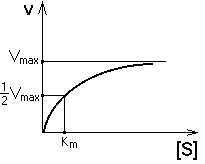
ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ СУБСТРАТА ПРИ [E] = const и [S] >> [E].
Чем выше концентрация субстрата, тем выше скорость реакции. Эта зависимость гиперболическая.
|
Предельное значение, к которому стремится гипербола - Vmax данной реакции - характеризует максимальную работоспособность фермента:
Vmax=k+2.[E]
Таким образом, Vmax - это предел, к которому стремится скорость реакции при бесконечном повышении концентрации субстрата.
Км - это КОНСТАНТА МИХАЭЛИСА. Она численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимального значения.
Эта кривая описывается уравнением Михаэлиса-Ментен:
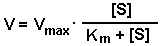
ФИЗИЧЕСКИЙ СМЫСЛ Км заключается в том, что она представляет собой константу равновесия между двумя реакциями, приводящими к распаду фермент-субстратного комплекса и той реакцией, которая ведет к образованию этого комплекса.
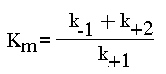
Поскольку значение k+2 всегда намного ниже, чем k-1, то
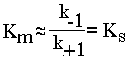
Ks - субстратная константа. Характеризует константу равновесия 1-го этапа ферментативной реакции. Следовательно, Км обычно тоже довольно близка к Кs. Следовательно, Км, как и Кs, характеризует сродство субстрата к данному ферменту. Но экспериментально определить k-1 и k+2 очень трудно, поэтому трудно определить и Кs. А вот Км можно просто определить, используя координаты Лайнуивера-Бэрка ("Ферменты" стр. 26-27).
С помощью Км можно характеризовать сродство данного фермента к данному субстрату. Чем меньше Км, тем больше сродство фермента к данному субстрату, а значит тем больше равновесие первого этапа ферментативной реакции сдвинуто вправо - в сторону образования фермент-субстратного комплекса. Значит, будут созданы наилучшие условия для протекания и второго этапа ферментативного процесса. При таких условиях для достижения эффективного превращения субстрата требуется малая концентрация субстрата. Значит, и Vmax теоретически может быть достигнута при малых количествах субстрата.
Если Км высока, то это означает, что сродство фермента к такому субстрату низкое и реакция при небольших концентрациях субстрата протекает неэффективно.
Км и Vmax - это две кинетические константы, с помощью которых можно характеризовать эффективность работы фермента, в том числе и in vivo.
Дата добавления: 2016-06-22; просмотров: 2195;











