КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
План
1. Значение комплексных соединений (КС).
2. Координационная теория строения КС А.Вернера. Природа связи в КС.
Классификация КС.
3. Номенклатура КС.
4. Пространственное строение КС. Магнитные и оптические свойства КС.
5. Устойчивость КС.
6. Получение и разрушение КС.
Литература.
1. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
2. Курс общей химии под ред. Коровина Н.В. и др. Гл.X, §X.l-X.5.
Комплексные или координационные соединения (КС) составляют наиболее разнообразный класс неорганических веществ, имеющий большое значение в природе и технике. По своему составу КС являются более сложными, чем оксиды, гидроксиды, кислоты и соли. Реакции комплексообразования лежат в основе получения редких и драгоценных металлов, чистых и сверхчистых веществ, аналитических определений, гальванотехнических процессов, получения лекарств, антидетонаторов, антиоксидантов и т.д.
Неоценима роль КС в биологических процессах. Такие жизненно важные природные соединения, как гемоглобин, хлорофилл, инсулин, некоторые витамины относятся также к координационным соединениям.
Строение и механизм образования химических связей в КС наиболее удачно обьясняет координационная теория, предложенная в 1893 г. А.Вернером. Причиной комплексообразования может быть как электростатическое, так и донорно-акцепторное взаимодействие. Рассмотрим механизм образования молекулы [Ag(NH3)2]Cl: AgCl + 2NH4OH ® [Ag (NH3) 2] Cl + 2H2O
В молекуле [Ag(NH3)2]Cl ион серебра имеет следующее строение: Ag0 (4d105s1) 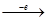 Ag+(4d105s0), ион хлора -соответственно:
Ag+(4d105s0), ион хлора -соответственно:
Cl0 (3s23p5) 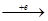 Cl- (3s23p6).
Cl- (3s23p6).
Взаимодействие катиона Ag  c анионом Cl¯ носит электростатический характер: Ag+ + Cl-
c анионом Cl¯ носит электростатический характер: Ag+ + Cl-  AgCl ионная связь . При образовании комплексного иона [Ag(NH3)2]
AgCl ионная связь . При образовании комплексного иона [Ag(NH3)2]  катион Ag
катион Ag  выступает в качестве акцептора готовой электронной пары, предоставляя, свободные орбитали (5s и 5p) для координации; молекулы аммиака выступают в качестве донора электронной пары. Химическая связь такого вида называется донорно-акцепторной или координационной. По своей природе - это полярная ковалентная связь, отличие состоит лишь в способе её образования. Координационные соединения состоят из внешней и внутреннейсфер.
выступает в качестве акцептора готовой электронной пары, предоставляя, свободные орбитали (5s и 5p) для координации; молекулы аммиака выступают в качестве донора электронной пары. Химическая связь такого вида называется донорно-акцепторной или координационной. По своей природе - это полярная ковалентная связь, отличие состоит лишь в способе её образования. Координационные соединения состоят из внешней и внутреннейсфер.
[H3N:←□ Ag□←: NH3] 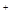 Cl‾
Cl‾
внутренняя сфера внешняя сфера
Различают внутренние сферы
1.Катионного характера: [Ag(NH)2]  ;[Cu(NH3)4]
;[Cu(NH3)4] 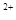
2.Анионного характера: [Co(CN)4] 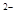 ; [Fe(CN)6]
; [Fe(CN)6] 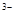
3.Нейтрального характера: [Fe (CO) 5]
Комплексную частицу, например, 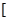 Cr3+(H2O)0 6
Cr3+(H2O)0 6 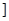 3+ образуют:
3+ образуют:
- Центральный атом (ЦА) или, его так же называют комплексообразователь (КО) – это катион хрома Cr3+
- Лиганды (L) - в нашем примере это молекулы воды, которые координируются вокруг ЦА, их количество (6) соответствует значению координационного числа (КЧ = 6).
Заряд комплексного иона равен алгебраической сумме зарядов ЦА и L:
К2+ 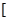 Pt2+Cl4-
Pt2+Cl4- 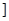 2-;
2-; 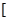 Cr3+(H2O)0 6
Cr3+(H2O)0 6 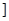 3+Cl3-
3+Cl3- 
В качестве комплексообразователей может быть любой элемент периодической системы, но наибольшую склонность к комплексообразованию имеют d- и f- металлы, некоторые р-элементы.
Координационное число (КЧ) - определяет количество s- связей, образуемых центральным атомом с лигандами (табл.№ 16)
Координационное число зависит от многих факторов: RЦА, заряда ЦА, размеров и валентности лигандов, среды в которой протекает реакция комплексообразования.
Таблица №16 Зависимость КЧ от заряда ЦА
| Заряд ЦА | КЧ | Пример |
| +1 | 2,3,4, но чаще всего 2 | Ag+, Cu+, Au+ [Ag (NH3) 2] Cl |
| +2 | 3,4,5,6,7,8, но чаще всего 4 | Cu2+, Fe2+, Zn2+, Hg2+, Au2+, Pt2+, Pb2+ [Cu (H2O) 4]SO4, Na2[Zn(OH)4], K4 [Fe(CN)6] |
| +3 | 4,5,6,8,9,10,12, но чаще всего 6 | Fe3+, Cr3+, Co3+ , Al3+, K3 [Fe (CN) 6] |
| +4 | 6,8, | Pt4+,Pb4+ , K2 [PtCl6] , K4 [PtCl8] |
Лигандамимогут быть нейтральные молекулы или анионы, простые или сложные молекулы органических веществ, у которых имеются неподеленные электронные пары.
По числу химических связей, образуемых лигандами с центральным атомом, лиганды можно разделить на:
- монодентатные : F‾; Cl‾; I‾; 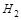
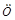 ;
; 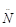
 и т.д..
и т.д..
-бидентатные - :SO4²‾ ;:NH2-(CH2)2 –Н2N: - этилендиаммин (ЭДА) .
- полидентатные: :OOCH2C CH2COО:




 -(CH2)2-
-(CH2)2- 
:OOCH2С CH2COO:
Этилендиаминтетрауксусная кислота
По наличию заряда, выделяют лиганды:
-анионного типа: CN‾; Cl‾ ; OH‾ ; CNS‾
-нейтрального типа: NH3; H2О ; CO ; NO ; ЭДА .
Комплексные соединения по химической природе лигандов делятся на четыре класса.
Дата добавления: 2020-04-12; просмотров: 481;











