Оксидом называется сложное вещество, состоящее из атомов двух элементов, один из которых - кислород.
Поскольку кислород соединяется почти со всеми элементами, существуют оксиды как металлов, так и неметаллов. Оксиды металлов, подобно CuO, Fe2O3, СаО – твердые вещества. Оксиды неметаллов могут быть как твердые (P2O5), так и жидкие (H2O) и газообразные (как SO2 и CO2).
Элементы с переменной валентностью могут образовывать несколько оксидов. Чтобы их отличать, в названии оксида указывают валентность связанного с кислородом элемента. Нам уже встречались такие названия в предыдущем параграфе. Приведем еще примеры:
SO2 – оксид серы (IV), SO3 – оксид серы (VI)
Cr2O3 – оксид хрома (III), CrO3 – оксид хрома (VI)
В зависимости от химических свойств различают:
Солеобразующие оксиды:
основные оксиды(например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
Несолеобразующие оксиды:оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO.
Химические свойства
Основные оксиды
1. Основный оксид + cильная кислота → соль + вода
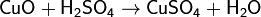
2. Сильноосновный оксид + вода → щелочь
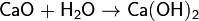
3. Сильноосновный оксид + кислотный оксид → соль
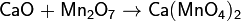
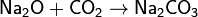
4. Основный оксид + водород → металл + вода
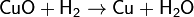
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды
1. Кислотный оксид + вода → кислота
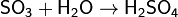
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль
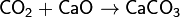
3. Кислотный оксид + основание → соль + вода
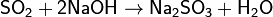
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
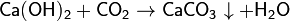
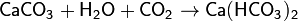
4. Нелетучий оксид + соль1 → соль2 + летучий оксид
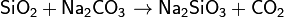
5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1
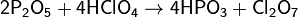
Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
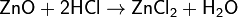
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
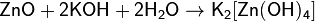 (в водном растворе)
(в водном растворе)
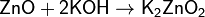 (при сплавлении)
(при сплавлении)
Получение
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
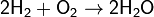
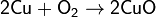
При горении в кислороде щелочных металлов (кроме лития), а также стронция и бария образуются пероксиды и надпероксиды:
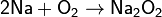
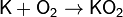
2. Обжиг или горение бинарных соединений в кислороде:
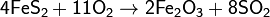
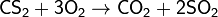
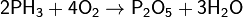
3. Термическое разложение солей:
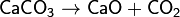
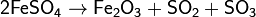
4. Термическое разложение оснований или кислот:
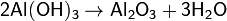
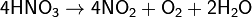
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
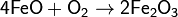
6. Взаимодействие некоторых металлов с водой при высокой температуре:
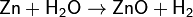
7. Взаимодействие солей с кислотными оксидами при сжигании кокса с выделением летучего оксида:
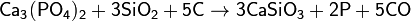
8. Взаимодействие металлов с кислотами-оксилителями:
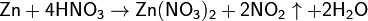
9. При действии водоотнимающих веществ на кислоты и соли:
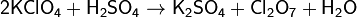
10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
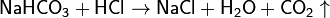
| Формула | Название | Формула | Название |
| CO | оксид углерода ( II ) | Fe2O3 | оксид железа (III ) |
| NO | оксид азота ( II ) | CrO3 | оксид хрома (VI ) |
| N2O5 | оксид азота (V ) | Mn2O7 | оксид марганца (VII ) |
ПОЛУЧЕНИЕ ОКСИДОВ.
| Окисление кислородом | простых веществ | 2Mg +O2=2MgO |
| сложных веществ | 2H2S+3O2=2H2O+2SO2 | |
| Разложение | нагреванием солей | СaCO3=CaO+CO2 
|
| нагреванием оснований | Cu (OH)2=CuO+H2O | |
| нагреванием кислородсодержащих кислот | H2SO3=H2O+SO2 
| |
| нагреванием высших оксидов | 4CrO3=Cr2O3+3O2 
| |
| Окисление низших оксидов | 4FeO+O2=2Fe2O3 | |
| Вытеснение летучего оксида менее летучим | Na2CO3+SiO2=Na2SiO3+CO2 
|
Дата добавления: 2016-06-22; просмотров: 2864;











