Квантовые числа электронов
Основные понятия и законы химии. Современные представления о строении атома.
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс. неорганических и более 4 млн. органических соединений.
Химические явления: одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, при этом состав ядер атомов не изменяется.
Физические явления: меняется физическое состояние веществ (парообразование, плавление, электропроводность, выделение тепла и света, ковкость и др.) или образуются новые вещества с изменением состава ядер атомов.
Строение атома.
1. Все вещества состоят из молекул. Молекула- наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек.
Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением.
Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
| Массовое число Э Заряд ядра Z | 63 29 | Cu и | 65 29 | Cu; | 35 17 | Cl и | 37 17 | Cl |
Химическая формула - это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс - цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Аллотропия - явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам. Простые вещества- молекулы, состоят из атомов одного и того же элемента.
Cложные вещества - молекулы, состоят из атомов различных химических элементов.
Международная единица атомных масс равна 1/12 массы изотопа 12C - основного изотопа природного углерода.
1 а.е.м = 1/12 • m (12C) = 1,66057 • 10-24 г
Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
Ar(Mg) = 24,312
m (Mg) = 24,312 • 1,66057 • 10-24 = 4,037 • 10-23 г
Относительная молекулярная масса (Mr)- безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Mг = mг / (1/12 mа(12C))
mr - масса молекулы данного вещества;
mа(12C) - масса атома углерода 12C.
Mг = S Aг(э). Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Квантовые числа электронов
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним.
Пример.
Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, cодинаковыми n и l - подуровнем.
Для
l=0 s- подуровень, s- орбиталь – орбиталь сфера
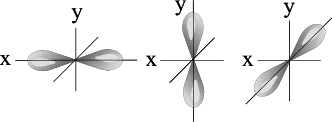
l=1 p- подуровень, p- орбиталь – орбиталь гантель
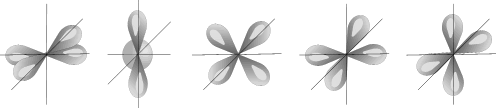
l=2 d- подуровень, d- орбиталь – орбиталь сложной формы
f-подуровень, f-орбиталь – орбиталь еще более сложной формы
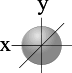
| 
|
| S - орбиталь | Три p – орбитали |
|
| Пять d – орбиталей |
Таким образом, на третьем энергетическом уровне могут быть три энергетических подуровня - 3s, 3p и 3d.
Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0. Это означает, что для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве.
Для s- орбитали (l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь разные ориентации в пространстве.
Для p- орбитали (l = 1) - три равноценные ориентации в пространстве (2l + 1 = 3): m = -1, 0, +1.
Для d- орбитали (l = 2) - пять равноценных ориентаций в пространстве (2l + 1 = 5): m = -2, -1, 0, +1, +2.
Таким образом, на s- подуровне - одна, на p- подуровне - три, на d- подуровне - пять, на f- подуровне - 7 орбиталей.
Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения.
Дата добавления: 2016-06-22; просмотров: 5309;











