Общая характеристика металлов
Металлы выделяются среди других элементов периодической системы, прежде всего своими физическими свойствами:
1. Они являются особенно хорошими проводниками теплоты и электрического тока.
2. Они обладают металлическим блеском, т. е. хорошо отражают свет.
3. Они ковки и пластичны.
4. Они легко образуют сплавы.
Несмотря на проявление общих свойств, различие между металлами нередко оказывается весьма существенным. Например, вольфрам плавится при 3380˚С, а цезий – при 28,5˚С. Вместе с тем у металлов, расположенных рядом друг с другом в периодической системе, часто проявляется близость свойств, в том числе химических. Такие металлы принято объединять в специальные группы. Выделяют следующие группы металлов: щелочные (Li, Na, K, Rb, Cs), щелочноземельные (Be, Mg, Ca, Sr, Ba), переходные элементы (элементы IB – VIIIB групп), лантаноиды (  ) и актиноиды (
) и актиноиды (  ). Из числа переходных металлов в особую группу выделяют платиновы металлы (Ru, Rh, Pd, Os, Ir, Pt). Все эти металлы являются s-, d- или f-элементами. К металлам относят также некоторые из р-элементов (Al, Ga, In, Sn, Tl, Pb, Bi), которые расположены в нижней части групп периодической системы.
). Из числа переходных металлов в особую группу выделяют платиновы металлы (Ru, Rh, Pd, Os, Ir, Pt). Все эти металлы являются s-, d- или f-элементами. К металлам относят также некоторые из р-элементов (Al, Ga, In, Sn, Tl, Pb, Bi), которые расположены в нижней части групп периодической системы.
Физические и химические свойства металлов в значительной мере определяются особенностями электронного строения их атомов. На внешнем электронном уровне атомов металлов обычно три и менее электрона. Например:
Na 1s22s22p63s1,
Cu 1s22s22p63s23p63d104s1,
Fe 1s22s22p63s23p63d64s2,
Al 1s22s22p63s23p1.
Высокая электропроводность металлов обусловлена подвижностью их валентных электронов. С позиций зонной теории металлов важным является то, что при малом числе валентных электронов в атомах металла зона проводимости не полностью заполнена электронами и создаются благоприятные условия для электронной проводимости. Электропроводность металлов понижается с повышением температуры.
Зонная теория объсняет причины различия свойств металлов, полупроводников и диэлектриков.
Поверхность металлов отражает свет. Особенностью металлов является отражение света под разными углами, в отличие от многих неметаллов (сера, иод), которые отражают свет под малыми углами. Отражение света металлами связано с поглощением энергии света «свободными» электронами, которые переходят за счет поглощенной энергии в возбужденное состояние и быстро возвращаются в исходное (основное) состояние, испуская энергию в виде света в окружающее пространство. Обычно металлы практически полностью сохраняют спектр световых волн при их отражении. Но некоторые металлы, например золото, поглощают световые волны некоторых частот в большей мере, чем другие, и поэтому приобретают цвет.
Ковкость (способность к расплющиванию) и пластичность (способность вытягиваться в проволоку и ленту)металлов прявляются в том, что их структура может деформироваться под действием внешних сил. Пластичность металлов уменьшается в ряду  ... Золото можно прокатывать в листы, толщиной до 0,003 мм, которые используются для золочения.
... Золото можно прокатывать в листы, толщиной до 0,003 мм, которые используются для золочения.
Плотность металлов, как и других прстых веществ, находится в периодической зависимости от порядкового номера элемента.
К легким (  г/см3) относятся s-металлы и алюминий, скандий и титан, минимальную плотность имеет литий (
г/см3) относятся s-металлы и алюминий, скандий и титан, минимальную плотность имеет литий (  г/см3), к тяжелым относятся в основном d-металлы 5-7-го периодов. Максимальную плотность имеет осмий (
г/см3), к тяжелым относятся в основном d-металлы 5-7-го периодов. Максимальную плотность имеет осмий (  г/см3). Температура плавления металлов также имеет периодическую зависимость от порядкового номера элемента. К лекгоплавким относятся в основном s- и p-элементы, а также d-элементы II группы. К тугоплавким (tпл выше 15000С) принадлежат, в основном, d-металлы IV-VIII групп. Минимальную температуру плавления имеет ртуть (
г/см3). Температура плавления металлов также имеет периодическую зависимость от порядкового номера элемента. К лекгоплавким относятся в основном s- и p-элементы, а также d-элементы II группы. К тугоплавким (tпл выше 15000С) принадлежат, в основном, d-металлы IV-VIII групп. Минимальную температуру плавления имеет ртуть (  ), максимальную – вольфрам (
), максимальную – вольфрам (  ).
).
Вследствие ненасыщенности и ненаправленности металлической связи для кристаллических решеток металлов характерна высокая плотность упаковки. Большинство металлов кристаллизуется с образованием гексагональных или кубических (гранецентрированных или объемно центрированных) решеток.
Самый твердый из металлов хром – режет стекло, а самые мягкие – калий, рубидий, цезий – легко режутся ножом.
Металлы отличаются также своим отношением к магнитным полям. По этому свойству они делятся на три группы :
- ферромагнитные металлы – способные намагничиваться под действием слабых магнитных полей (железо, кобальт, никель);
- парамагнитные металлы – проявляют слабую способность к намагничиванию (алюминий, титан и большая часть лантаноидов);
- диамагнитные металлы – не притягиваются к магниту и даже отталкиваются от него (висмут, олово, медь).
Пыль и пары некоторых металлов токсичны. Как известно, токсичность характеризуется предельно-допустимыми концентрациями веществ в рабочей зоне, ПДК ( 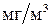 ). К наиболее токсичным относятся металлы (ПДК -
). К наиболее токсичным относятся металлы (ПДК - 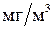 ): Be (10-3), Hg (10-3), Pb (10-2), Cd (10-2), Ag (10-2), Ni, Rh, Tl, In (10-1).
): Be (10-3), Hg (10-3), Pb (10-2), Cd (10-2), Ag (10-2), Ni, Rh, Tl, In (10-1).
Дата добавления: 2020-03-21; просмотров: 606;











